
【题目】图表示某可逆反应在使用和未使用催化剂时,反应过程和能量的对应关系。下列说法一定正确的是

A. 该反应为吸热反应 B. a与b相比,a的反应速率更快
C. a与b相比,反应的平衡常数一定不同 D. 降低温度有利于该反应向正反应方向进行
科目:高中化学 来源: 题型:
【题目】下列说法正确的是( )
A. 在外加电流的阴极保护法中,须将被保护的钢铁设备与直流电源的负极相连
B. 反应H2S(g)+ZnO(s)===H2O(g)+ZnS(s)在一定条件下可自发进行,且ΔS<0,则ΔH>0
C. 常温常压,氢氧燃料电池工作消耗2.24 L O2时,转移电子的数目为0.4×6.02×1023
D. 常温下,Ksp[Cu(OH)2]=2.6×10-19,pH=10的含Cu2+的溶液中,c(Cu2+)≥2.6×10-11mol·L-1
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】硫、铁及其化合物用途非常广泛。回答下列问题:
(1)基态S原子价电子排布式为________,基态Fe原子未成对电子数为________个。
(2)团簇 中,S、C、N的化合价依次为-2、+2、-3,Fe2+与Fe3+数目之比为________;与铁形成配位键的原子是________。
中,S、C、N的化合价依次为-2、+2、-3,Fe2+与Fe3+数目之比为________;与铁形成配位键的原子是________。
(3)工业上主要通过反应SO3+SCl2=SOCl2+SO2制备SOCl2(氯化亚砜),上述四种分子中,属于非极性分子的是________;SCl2分子空间构型为________形;SOCl2分子中心原子杂化方式是________。
(4)黄铁矿的晶体结构如图所示,已知黄铁矿晶胞参数为a=0.5417nm,阿伏加德罗常数的值为NA。则黄铁矿的密度为________g·cm-3(列出计算式)。
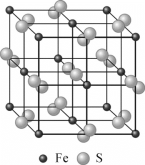
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】化学与生活密切相关。下列说法正确的是
A. 垃圾分类中可回收物标志:![]()
B. 农谚“雷雨肥庄稼”中固氮过程属于人工固氮
C. 绿色化学要求从源头上减少和消除工业生产对环境的污染
D. 燃煤中加入CaO可以减少酸雨的形成及温室气体的排放
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】以下是生物体内四种有机物的组成与功能关系图,如图1,请据图回答:

(1)小麦种子细胞中,物质A是______________,物质E是______________。艾滋病毒中的H彻底水解后可以得到________种产物。
(2)相同质量的E和F彻底氧化分解,耗氧量较多的是___________。
(3)若a个C物质组成b条链,组成某种物质G,该物质G至少含有氧原子的个数是________。若G是一条含121个氨基酸构成的链状结构,其中含5个甘氨酸(其R基为-H),分别位于26、71、72、99、121位(见下图)。
![]()
肽酶E1专门水解甘氨酸羧基端的肽键,肽酶E2专门水解甘氨酸氨基端的肽键。肽酶E1完全作用后产生的多肽中,至少有________个羧基。
(4)图二表示小麦开花数天后测定的种子中主要物质的变化图,请据图回答问题:
①小麦成熟种子中主要的有机营养物质是________,检测可溶性还原糖的试剂是_________,可溶性还原糖的多少可以通过________________来判断。
②种子成熟时,淀粉的形成与一种磷酸化酶的活性有密切关系,为了验证磷酸化酶是否为蛋白质,实验过程中实验组试管中加入2ml________,对照组试管中加入_______,然后在两支试管中分别加入等量双缩脲试剂,如果实验组试管中同样出现____________现象,则证明磷酸化酶是蛋白质。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下图是一种正投入生产的大型蓄电系统。放电前,被膜隔开的电解质为Na2S2和NaBr3,放电后分别变为Na2S4和NaBr。下列叙述正确的是

A. 放电时,负极反应为3NaBr-2e-==NaBr3+2Na+
B. 充电时,阳极反应为2Na2S2-2e-== Na2S4+2Na+
C. 放电时,Na+经过离子交换膜,由b池移向a池
D. 用该电池电解饱和食盐水,产生2.24LH2时,b池生成17.40g Na2S4
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】金属钒被誉为“合金的维生素”。从废钒(主要成分为V2O5、Fe2O3、SiO2等)中回收V2O5的一种工艺流程如下图所示:

已知:
步骤②、③中的变化过程可简化为:Rn+(水层)+nHA(有机层)![]() RAn(有机层)+nH+(水层)(式中Rn+表示VO2+或Fe3+,HA表示有机萃取剂)
RAn(有机层)+nH+(水层)(式中Rn+表示VO2+或Fe3+,HA表示有机萃取剂)
回答下列问题:
(1)步骤D酸浸过程中发生氧化还原反应的化学方程式为______________________。
(2)萃取时应加入适量碱的作用是___________________。
(3)步骤④中反应的离子方程式为___________________。
(4)步骤⑤加入氨水调节溶液pH=2,钒沉淀率达到93%且不产生Fe(OH)3沉淀,则此时溶液中c(Fe3+)<_____mol/L(按25℃计算,25℃时Ksp[Fe(OH)3]=2.6×10-39)。所得NH4VO3为离子化合物,NH4+的电子式为_______。
(5)V2O5是两性氧化物,在强酸性溶液中以VO2+形式存在,VO2+具有强氧化性,能将I-氧化为I2,本身被还原为V0+,则V2O5与氢碘酸反应的离子方程式为_________________。
(6)为提高钒的回收率,步骤②和③需多次进行,假设酸浸所得“强酸性浸出液”中c(VO2+)=amol/L,步骤②和③每进行一次,VO2+萃取率为80%,4次操作后,“强酸性浸出液中”c(VO2+)=_______mol/L(萃取的量=![]() )
)
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com