
 某化学课外小组查阅资料得知:苯和液溴在有溴化铁(FeBr3)存在的条件下可发生反应生成溴苯和溴化氢,此反应为放热反应.他们设计了如图装置制取溴苯.先向分液漏斗中加入苯和液溴,再将混合液慢慢滴入反应器A中.如图是制取溴苯的装置.试回答:
某化学课外小组查阅资料得知:苯和液溴在有溴化铁(FeBr3)存在的条件下可发生反应生成溴苯和溴化氢,此反应为放热反应.他们设计了如图装置制取溴苯.先向分液漏斗中加入苯和液溴,再将混合液慢慢滴入反应器A中.如图是制取溴苯的装置.试回答: .
.分析 由制备溴苯的装置可知,A中苯与液溴发生取代反应生成溴苯、HBr,溴苯不溶于水、密度比水大,B中四氯化碳可除去溴,C中HBr与硝酸银反应生成AgBr沉淀,若没有B装置而将A、C直接相连,溴易挥发,溴与硝酸银反应,不能说明HBr的生成,以此来解答.
解答 解:(1)装置A中发生反应的化学方程式是2Fe+3Br2=2FeBr3、 ,
,
故答案为:2Fe+3Br2=2FeBr3、 ;
;
(2)装置C中看到的现象是导管口有白雾,试管内有淡黄色的沉淀生成,证明有HBr生成,
故答案为:导管口有白雾,试管内有淡黄色的沉淀生成;有HBr生成;
(3)装置B是吸收瓶,内盛CCl4液体,可除去溴.如果没有B装置而将A、C直接相连,方法不妥,因逸出的溴蒸气也能与AgNO3溶液反应,
故答案为:否; 逸出的溴蒸气也能与AgNO3溶液反应;
(4)实验完毕后将A试管中的液体倒在装有冷水的烧杯中,混合物分层,烧杯下层为溴苯,这说明溴苯不溶于水且密度比水大,
故答案为:下;不溶于水;密度比水大.
点评 本题考查有机物的制备实验,为高频考点,把握制备实验装置、制备原理、有机物的性质为解答的关键,侧重分析与实验能力的考查,注意取代反应的特点及溴易挥发的性质,题目难度不大.


科目:高中化学 来源: 题型:解答题

 中①、②、③三个-OH与钠反应活性由强到弱的顺序是③>①>②.
中①、②、③三个-OH与钠反应活性由强到弱的顺序是③>①>②. ,1molF在一定条件下与足量NaOH溶液反应,做多消耗NaOH的物质的量为3 mol,符合下列条件的F的所有同分异构体有四种(不考虑立体异构),写出其中两种的结构简式:
,1molF在一定条件下与足量NaOH溶液反应,做多消耗NaOH的物质的量为3 mol,符合下列条件的F的所有同分异构体有四种(不考虑立体异构),写出其中两种的结构简式: .
. 下列流程是A的一种合成方法,写出方框中各物质的结构简式:
下列流程是A的一种合成方法,写出方框中各物质的结构简式:
查看答案和解析>>
科目:高中化学 来源: 题型:解答题

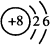 .
. ;物质n的用途有生产盐酸(任写一种即可).
;物质n的用途有生产盐酸(任写一种即可).查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | C5H12(l)+8O2(g)═5CO2(g)+6H2O(l)△H=-3 540 kJ•mol-1 | |
| B. | C5H12(l)+8O2(g)═5CO2(g)+6H2O(g)△H=-3 540 kJ•mol-1 | |
| C. | C5H12(l)+8O2(g)═5CO2(g)+6H2O(g)△H=+3 540 kJ•mol-1 | |
| D. | C5H12(l)+8O2(g)═5CO2(g)+6H2O(l)△H=+3 540 kJ•mol-1 |
查看答案和解析>>
科目:高中化学 来源: 题型:实验题

查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| t℃ | 700 | 800 | 830 | 1000 | 1200 |
| K | 0.6 | 0.9 | 1.0 | 1.7 | 2.6 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| 时间t/h | 0 | 5 | 10 | 15 | … | 25 | 30 |
| 总压强p/100kPa | P0 | 1.5P0 | 1.75P0 | 1.875P0 | … | 1.95P0 | 1.95P0 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题


 ,E中含氧官能团的名称为羟基、碳碳三键.
,E中含氧官能团的名称为羟基、碳碳三键. .
. .
. (任写一种).F的所有同分异构体在下列一种表征仪器中显示的信号(或数据)完全相同,该仪器是d(填字母).
(任写一种).F的所有同分异构体在下列一种表征仪器中显示的信号(或数据)完全相同,该仪器是d(填字母). ,其他试剂任选.
,其他试剂任选.查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com