
| A、常温时,A能从水中置换出氢,而B不能 |
| B、A原子电子层数比B原子的电子层数多 |
| C、1 mol A 与足量的酸反应生成的H2比1 mol B生成的H2多 |
| D、A原子的最外层电子数比B原子的最外层电子数少 |


 黄冈小状元解决问题天天练系列答案
黄冈小状元解决问题天天练系列答案 三点一测快乐周计划系列答案
三点一测快乐周计划系列答案科目:高中化学 来源: 题型:

查看答案和解析>>
科目:高中化学 来源: 题型:
 某同学对Cl2与KI溶液的反应进行了实验探究.反应装置如下:
某同学对Cl2与KI溶液的反应进行了实验探究.反应装置如下:| 操作 | 实验现象 | |
| a | 取2~3mL黄色溶液,加入足量CCl4,振荡静置 | CCl4层呈紫红色,水层显浅黄色 |
| b | 取2~3mL饱和碘水,加入足量CCl4,振荡静置 | CCl4层呈紫红色,水层近乎无色 |
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、向Ba(OH)2溶液中逐滴加入NH4HSO4溶液至刚好沉淀完全:Ba2++2OH-+H++SO42-+NH4+═BaSO4↓+NH3?H2O+H2O |
| B、碘化钾与适量溴水反应:2I-+Br2═I2+2Br- |
| C、硫化钾的水解:S2-+2H2O?H2S+2OH- |
| D、向NaHCO3溶液中滴加少量澄清石灰水:2HCO3-+Ca2++2OH-═CaCO3↓+2H2O+CO32- |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、向煮沸的1mol/L NaOH溶液中滴加FeCl3饱和溶液制备Fe(OH)3胶体 |
| B、光线透过胶体时,胶体发生丁达尔效应 |
| C、直径介于1nm--100nm之间的微粒称为胶体 |
| D、分散系中分散质粒子的直径:Fe(OH)3悬浊液>Fe(OH)3胶体>FeCl3溶液 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、碳酸氢钙溶液加到醋酸溶液中:Ca(HCO3)2+2CH3COOH═Ca2++2CH3COO-+2CO2↑+2H2O | ||||
B、用惰性电极电解氯化镁溶液:2Cl-+2H2O
| ||||
| C、电解精炼铜的阳极反应式只有:Cu-2e-=Cu2+ | ||||
| D、在氯化亚铁溶液中加入稀硝酸:3Fe2++4H++NO3-═3Fe3++NO↑+2H2O |
查看答案和解析>>
科目:高中化学 来源: 题型:
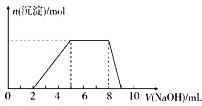 某溶液中可能含有如下离子:H+、Mg2+、Al3+、NH4+、Cl-、[Al(OH)4]-.当向该溶液中逐滴加入NaOH溶液时,产生沉淀的物质的量(n)与加入NaOH溶液的体积(V)的关系如图所示,下列说法正确的是( )
某溶液中可能含有如下离子:H+、Mg2+、Al3+、NH4+、Cl-、[Al(OH)4]-.当向该溶液中逐滴加入NaOH溶液时,产生沉淀的物质的量(n)与加入NaOH溶液的体积(V)的关系如图所示,下列说法正确的是( )| A、原溶液中一定含有的阳离子是H+、Mg2+、Al3+、NH4+ |
| B、反应最后形成的溶液中的溶质含AlCl3 |
| C、原溶液中Al3+与NH4+的物质的量之比为1:3 |
| D、原溶液中含有的阴离子是[Al(OH)4]-、Cl- |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com