
| A. | ①② | B. | ③④ | C. | ① | D. | ①⑤ |
 英才点津系列答案
英才点津系列答案 红果子三级测试卷系列答案
红果子三级测试卷系列答案科目:高中化学 来源: 题型:选择题
| A. | 1:1 | B. | 1:2 | C. | 1:3 | D. | 2:1 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
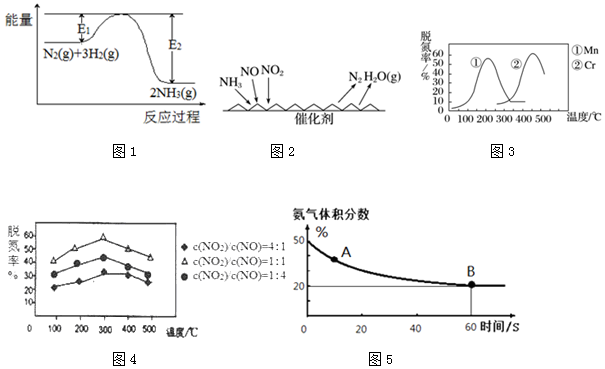
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
 常温下饱和CO2溶液的pH约为5.6.向某未知浓度的Na2CO3溶液中滴入已知浓度的盐酸时,用 pH传感器测得混合溶液的pH变化曲线如图所示,下列说法正确的是( )
常温下饱和CO2溶液的pH约为5.6.向某未知浓度的Na2CO3溶液中滴入已知浓度的盐酸时,用 pH传感器测得混合溶液的pH变化曲线如图所示,下列说法正确的是( )| A. | 该Na2CO3溶液的浓度为0.001mol/L | |
| B. | 在pH=7时,c(Na+)>c(Cl-) | |
| C. | 在pH=6时,c(Na+)>c(CO32-)>c(HCO3-) | |
| D. | c→d发生的主要离子反应为:CO32-+H+=HCO3- |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题

| A. | 图一:引发铝热反应的操作是点燃镁条 | |
| B. | 图二:可用于化学反应速率的测定 | |
| C. | 图三:滴加K3[Fe(CN)6]溶液,产生特征蓝色沉淀 | |
| D. | 图四:酸式滴定管注入Na2CO3溶液之前应检查是否漏液 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| 选项 | 物质(括号中为杂质) | 除杂试剂 | 操作 |
| A | 碳酸钡(硫酸钡) | 饱和碳酸钠溶液 | 搅拌、过滤 |
| B | CO2(HCl) | 饱和碳酸钠溶液 | 洗气 |
| C | FeCl3(FeCl2) | 足量铁粉 | 搅拌、过滤 |
| D | HCl(Cl2) | 饱和食盐水 | 洗气 |
| A. | A | B. | B | C. | C | D. | D |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 已知:
已知:
 .
. ;H的顺式结构简式为
;H的顺式结构简式为 .
. (任写一种).
(任写一种).
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 增加A物质的质量 | B. | 向容器中再充入B气体 | ||
| C. | 升高反应体系的温度 | D. | 从容器中移出部分C气体 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
 我国科学家屠呦呦因发现青蒿素治疗疟疾新疗法而获得2015年诺贝尔生理学或医学奖,已知青蒿素的结构简式如图.下列说法不正确的是( )
我国科学家屠呦呦因发现青蒿素治疗疟疾新疗法而获得2015年诺贝尔生理学或医学奖,已知青蒿素的结构简式如图.下列说法不正确的是( )| A. | 青蒿素可能具有强氧化性,具有杀菌消毒作用 | |
| B. | 青蒿素难溶于水,能溶于NaOH溶液 | |
| C. | 青蒿素分子中含有碳氧双键,但不能发生加成反应 | |
| D. | 青蒿素与纤维素一样,都属于有机高分子化合物 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com