
| A. | CO2和SiO2都是直线形分子 | |
| B. | H2O和NH3的VSEPR模型不同 | |
| C. | 由分子构成的物质中一定含有共价键 | |
| D. | 形成共价键的元素不一定是非金属元素 |
分析 A.SiO2是原子晶体,不存在分子;
B.根据中心原子的价层电子对数判断;
C.单原子分子中没有共价键;
D.金属元素与非金属元素也可能形成共价键.
解答 解:A.CO2是直线形分子,SiO2是原子晶体,不存在分子,故A错误;
B.H2O的O原子的价层电子对数=2+$\frac{1}{2}$(6-2×1)=4,NH3的N原子的价层电子对数=3+$\frac{1}{2}$(5-3×1)=4,价层电子对数相同,所以VSEPR模型相同,故B错误;
C.单原子分子中没有共价键,如稀有气体分子中没有共价键,故C错误;
D.金属元素与非金属元素也可能形成共价键,如AlCl3是金属与非金属元素形成的共价键,故D正确.
故选D.
点评 本题考查了分子的空间结构、化学键,价层电子对互斥理论的应用,题目难度中等,注意把握价层电子对互斥理论以及价层电子对数的计算方法.


科目:高中化学 来源: 题型:解答题
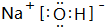 ,该化合物中所含的化学键有离子键、共价键.
,该化合物中所含的化学键有离子键、共价键.查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 铝片保存时可不密闭保存 | |
| B. | 金属钠保存在石蜡油或煤油中 | |
| C. | 氢氧化钠溶液盛装在用玻璃塞的试剂瓶中 | |
| D. | 硫酸亚铁溶液存放在加有少量铁粉的试剂瓶中 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 用VSEPR理论预测BF3和NF3的立体构型均为平面三角形 | |
| B. | CO2是直线形分子,其中碳原子的杂化轨道类型为sp3杂化 | |
| C. | 电子层结构相同的简单离子,其半径随核电荷数增大而减小 | |
| D. | 在化学反应中,某元素由化合态变为游离态,则该元素一定被还原 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
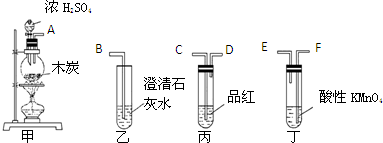
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
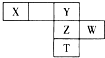 如图下表为元素周期表的一部分,X、Y、Z、W为短周期元素,其中X的最高正价与最低负价绝对值只差等于0.下列说法正确的是( )
如图下表为元素周期表的一部分,X、Y、Z、W为短周期元素,其中X的最高正价与最低负价绝对值只差等于0.下列说法正确的是( )| A. | X氢化物的沸点一定比Y氢化物的沸点低 | |
| B. | T的最高价氧化物对应的水化物酸性比Z的强 | |
| C. | Y的氢化物沸点高于Z的氢化物,因为H-Y键的键能高于H-Z键 | |
| D. | XY2、XZ2、XW4的化学键类型相同、晶体类型也相同 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com