
【题目】![]() 时,含硫各微粒
时,含硫各微粒![]() 、
、![]() 图所示。下列说法不正确的是
图所示。下列说法不正确的是
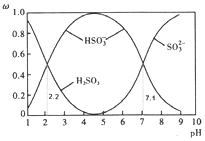
A.![]() 溶液显酸性
溶液显酸性
B.![]() 的溶液中不含
的溶液中不含![]()
C.在含![]()
![]() 、
、![]() 和
和![]() 的溶液中,加入少量NaOH固体,
的溶液中,加入少量NaOH固体,![]() 不一定增大
不一定增大
D.![]() 时,
时,![]()
![]()
【答案】B
【解析】
A.![]() 溶液中亚硫酸氢根离子水解平衡常数
溶液中亚硫酸氢根离子水解平衡常数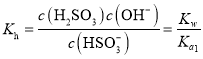 ,和
,和![]() 比较大小判断水解程度和电离程度大小;
比较大小判断水解程度和电离程度大小;
B.![]() 的溶液为亚硫酸钠溶液,亚硫酸根离子水解分步进行;
的溶液为亚硫酸钠溶液,亚硫酸根离子水解分步进行;
C.加入少量NaOH固体,![]() 可能增大也可能减小;
可能增大也可能减小;
D.![]() 时,
时,![]() ,结合电荷守恒分析判断离子浓度。
,结合电荷守恒分析判断离子浓度。
A.图象分析可知![]() ,
,![]() ,
,![]() 溶液中亚硫酸氢根离子水解平衡常数
溶液中亚硫酸氢根离子水解平衡常数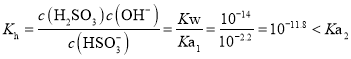 ,判断水解程度小于电离程度大小,溶液显酸性,故A不符合题意;
,判断水解程度小于电离程度大小,溶液显酸性,故A不符合题意;
B.![]() 的溶液为亚硫酸钠溶液,亚硫酸根离子水解分步进行,溶液中含
的溶液为亚硫酸钠溶液,亚硫酸根离子水解分步进行,溶液中含![]() ,故B符合题意;
,故B符合题意;
C.加入少量NaOH固体,若溶液中H2SO3较多,则随着溶液的pH增大,![]() 逐渐减小,
逐渐减小,![]() 逐渐增大,即
逐渐增大,即![]() 增大;若溶液中HSO3-较多,则HSO3-和OH-反应使
增大;若溶液中HSO3-较多,则HSO3-和OH-反应使![]() 降低,即
降低,即![]() 减小,故C不符合题意;
减小,故C不符合题意;
D.![]() 时,
时,![]() ,溶液中存在电荷守恒:
,溶液中存在电荷守恒:![]() ,
,![]() ,
,![]() ,故D不符合题意;
,故D不符合题意;
故选:B。


 七星图书口算速算天天练系列答案
七星图书口算速算天天练系列答案 初中学业考试导与练系列答案
初中学业考试导与练系列答案科目:高中化学 来源: 题型:
【题目】下列有关实验操作的说法正确的是
A.实验时手指不小心沾上苯酚,立即用浓NaOH溶液清洗
B.用润湿的红色石蕊试纸置于试管口,试纸变蓝,证明有氨气产生
C.将氯化铝溶液加热蒸发,最后可得到氯化铝晶体
D.酸碱中和滴定时,锥形瓶需用待测液润洗后,再加入待测液
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】如图所示装置中,a、b都是惰性电极,通电一段时间后,b极附近溶液呈红色,则下列说法正确的是( )

A.X是正极,Y是负极,CuSO4溶液的pH逐渐减小
B..X是正极,Y是负极,CuSO4溶液的pH保持不变
C.X是负极,Y是正极,CuSO4溶液的pH 逐渐减小
D.X是负极,Y是正极,CuSO4溶液的pH保持不变
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列有关平衡常数的说法中,正确的是( )
A.在任何条件下,化学平衡常数都是一个定值
B.反应 ![]() ,增大压强该反应平衡常数增大
,增大压强该反应平衡常数增大
C.对于给定可逆反应,温度一定时,其正、逆反应的平衡常数互为倒数
D.改变条件,若反应物的转化率增大,平衡常数也一定增大
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】根据下列实验现象所得出的结论正确的是
选项 | 实验现象 | 实验结论 |
A | 将铝片分别投入浓、稀硝酸中,前者无明显现象,后者反应剧烈 | 稀硝酸的氧化性比浓硝酸的强 |
B | 滴有酚酞的Na2CO3溶液中加入BaCl2溶液,红色变浅 | Na2CO3溶液中存在水解平衡 |
C | 某溶液中滴加过量氨水产生白色沉淀且不溶解 | 该溶液中一定含有Mg2+ |
D | 溴水中通入SO2,溴水褪色 | SO2具有漂白性 |
A. A B. B C. C D. D
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】设NA为阿伏伽德罗常数的值,下列说法正确的是
A. 1mol甲基中含有电子数为10NA
B. 常温下,1LpH=12的Na2CO3溶液中含有的OH-离子数为0.01 NA
C. 标准状况下,NO和O2各11.2L混合充分反应,所得气体的分子总数为0.75 NA
D. 50mL12mol·L-1盐酸和足量MnO2共热,转移的电子数为0.3 NA
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】一定条件下对于可逆反应![]() ,若X、Y、Z三种气体的初始浓度和平衡浓度如下表(c1、c2、c3均不为零):
,若X、Y、Z三种气体的初始浓度和平衡浓度如下表(c1、c2、c3均不为零):
物质 | X | Y | Z |
初始浓度(mol·L-1) | c1 | c2 | c3 |
平衡浓度(mol·L-1) | 0.2 | 0.3 | 0.12 |
则下列判断正确的是( )
A.c1∶c2=2∶3
B.平衡时Y和Z的生成速率之比为2∶3
C.X、Y的转化率之比为2:3
D.c1的取值范围为0<c1<0.3
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】将浸透了石蜡油的石棉放在试管中进行下列实验,请回答下列问题。
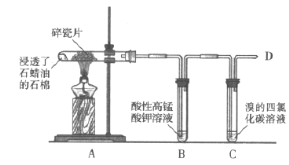
(1)反应一段时间后,B试管中的现象是___,由此说明石蜡油分解产生的气体具有___性(填“氧化”或“还原”)。
(2)若石蜡油分解产生乙烯,则C中发生反应的化学方程式是___。
(3)在D处点燃气体,观察到的现象是___。
(4)除去甲烷中混有的乙烯应采用的方法是___。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】工业上由黄铜矿(主要成分CuFeS2)冶炼铜的主要流程如下:

(1)气体A中的大气污染物可选用下列试剂中的_______吸收。
a.浓H2SO4 b.稀HNO3 c.NaOH溶液 d.氨水
(2)用稀H2SO4浸泡熔渣B,取少量所得溶液,滴加KSCN溶液后呈红色,说明溶液中存在_____(填离子符号),检验溶液中还存在Fe2+的方法是________________(注明试剂、现象)。
(3)由泡铜冶炼粗铜的化学反应方程式为_________________。
(4)以CuSO4溶液为电解质溶液进行粗铜(含Al、Zn、Ag、Pt、Au等杂质)的电解精炼,下列说法正确的是_________。
a.电能全部转化为化学能
b.粗铜接电源正极,发生氧化反应
c.溶液中Cu2+向阳极移动
d.阴极增加的质量一定与阳极减少的质量相同
e. 利用阳极泥可回收Ag、Pt、Au等金属
(5)利用反应2Cu+O2+2H2SO4=2CuSO4+2H2O可制备CuSO4,若将该反应设计为原电池,其正极电极反应式为______________________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com