
( 6分)请你设计两种方法除去细小的铁颗粒中混有的细小的铝颗粒。(简要说明)
(1)
(2)
 口算题卡北京妇女儿童出版社系列答案
口算题卡北京妇女儿童出版社系列答案科目:高中化学 来源: 题型:阅读理解
| ||
查看答案和解析>>
科目:高中化学 来源: 题型:

查看答案和解析>>
科目:高中化学 来源:2012年天津市河北区高考化学一模试卷(解析版) 题型:解答题
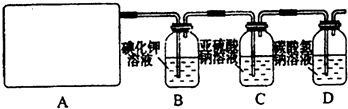
 2CaSO4+2Cl2↑+2H2O.他们设计了如下制取氯气并验证其性质的实验.
2CaSO4+2Cl2↑+2H2O.他们设计了如下制取氯气并验证其性质的实验.

查看答案和解析>>
科目:高中化学 来源: 题型:
化合物C是一种合成药品的中间体,其合成路线为:
|
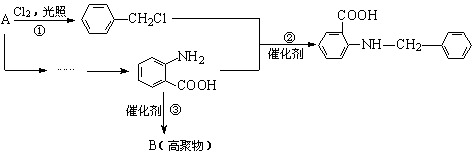
已知:

(1)写出![]() 中官能团的名称 ▲ 。
中官能团的名称 ▲ 。
(2)写出反应①的化学方程式 ▲ 。
(3)反应②属于 ▲ 反应(填有机反应类型)。
(4)产物C中有_____▲___种不同环境的的氢原子。
(5)写出满足下列条件的![]() 的同分异构体的结构简式 ▲ 。
的同分异构体的结构简式 ▲ 。
① 苯环上的一取代产物只有两种;
② 具有弱碱性,能发生银镜反应;
③ 水解后的产物能与FeCl3溶液发生显色反应。
(6)请你设计由A合成B的合成路线。
提示:①合成过程中无机试剂任选;②合成路线表示方法示例如下:
![]()
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com