
甲醇在催化剂作用下提供质子(H+)和电子,电子经外电路,质子经内电路到达另一极与氧气反应,电池总反应式为2CH3OH+3O2→2CO2+4H2O。下列关于该电池的分析:①甲醇是负极②H+向负极移动③负极反应:CH3OH-6e-+H2O=CO2+6H+ ④1 mol CH3OH完全反应转移12 mol电子 ⑤正极反应:O2+4e-+2H2O==4OH- ⑥该电池的电解质溶液可能是碱液。其中正确的是
A.①②⑥ B.②③④⑤ C.③ D.①③
科目:高中化学 来源:2016届黑龙江省高三第三次模拟理综化学试卷(解析版) 题型:填空题
下图是煤化工产业链的一部分,试运用所学知识,解决下列问题:
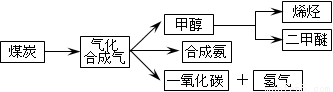
I.已知该产业链中某反应的平衡表常数达式为:K=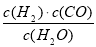 ,它所对应反应的化学方程式为 。
,它所对应反应的化学方程式为 。
II.二甲醚(CH3OCH3)在未来可能替代柴油和液化气作为洁净液体燃料使用,工业上以CO和H2为原料生产CH3OCH3。工业制备二甲醚在催化反应室中(压力2.0~10.0Mpa,温度230~280℃)进行下列反应:
①CO(g)+2H2(g) CH3OH(g) △H1=-90.7kJ·mol-1
CH3OH(g) △H1=-90.7kJ·mol-1
②2CH3OH(g) CH3OCH3(g)+H2O(g) △H2=-23.5kJ·mol-1
CH3OCH3(g)+H2O(g) △H2=-23.5kJ·mol-1
③CO(g)+H2O(g) CO2(g)+H2(g) △H3=-41.2kJ·mol-1
CO2(g)+H2(g) △H3=-41.2kJ·mol-1
(1)催化反应室中总反应的热化学方程式为 。
830℃时反应③的K=1.0,则在催化反应室中反应③的K 1.0(填“>”、“<”或“=”)。
(2)在某温度下,若反应①的起始浓度分别为:c(CO)=1 mol/L,c(H2)=2.4 mol/L,5 min后达到平衡,CO的转化率为50%;若反应物的起始浓度分别为:c(CO)=4 mol/L,c(H2)=a mol/L,达到平衡后,c(CH3OH)=2 mol/L,则a= mol/L。
(3)反应②在t℃时的平衡常数为400,此温度下,在0.5L的密闭容器中加入一定的甲醇,反应到某时刻测得各组分的物质的量浓度如下:
物质 | CH3OH | CH3OCH3 | H2O |
c(mol/L) | 0.8 | 1.24 | 1.24 |
①此时刻v正 v逆(填“大于”“小于”或“等于”)
②平衡时二甲醚的物质的量浓度是 。
(4)以二甲醚、空气、KOH 溶液为原料,以石墨为电极可直接构成燃料电池,则该电池的负极反应式为 ;若以1.12L/min(标准状况)的速率向电池中通入二甲醚,用该电池电解500mL2mol/L CuSO4溶液,通电0.50 min后,计算理论上可析出金属铜的质量为 。
查看答案和解析>>
科目:高中化学 来源:2016届湖南省等四校高三联考化学试卷(解析版) 题型:实验题
【选修2:化学与技术】某工厂废气中含有SO2,可将SO2转化为(NH4)2SO4而除去。其过程为:将废气经初步处理,使其中O2的体积分数为10%(这时SO2的体积分数为0.3%),并在400℃时以3 m3 • h-1的速率通过V2O5触媒层,然后与流量为25 L • h-1 的NH3混合,再喷入流量为290 g • h-1的冷水,此时气体温度迅速从400℃下 降至200℃,在结晶装置中得到(NH4)2SO4晶体。据此回答下列问题:
(1)废气经初步处理后控制SO2与O2的物质的量之比的理论依据是 。
(2)进行冷却的原因是 。
(3)合成氨时,原料N2不能用空气代替,而必须用纯N2,主要原因是 。
(4)有资料报道最近研制出一种性能优越的催化剂,可以将SO2全部催化氧化为SO3(2SO2+O2  2SO3)”。这种资料报道可信吗?_____ (填“可信”或“不可信',其理由是 。
2SO3)”。这种资料报道可信吗?_____ (填“可信”或“不可信',其理由是 。
(5)如果将SO2全部转化为SO3,SO3又全部转化成(NH4)2SO4,则按题给数据计算,NH3的每小时通入量至少应是_____L,由此可得出NH3的利用率为 。
(6)酸雨的危害很大,从源头上减少酸雨产生的途径,可采取的措施是 (填序号)。
A.植树造林 B.开发利用太阳能 C.少用煤作燃料 D.把工厂的烟囱造高
查看答案和解析>>
科目:高中化学 来源:2016届湖南省等四校高三联考化学试卷(解析版) 题型:选择题
能正确表示下列反应的离子方程式是
A.用过量石灰乳吸收工业尾气中的SO2: Ca2+ +2OH- +SO2=CaSO3 ↓+ H2O
B.用酸性KMnO4溶液与H2O2反应,证明H2O2具有还原性:2MnO4—+6H++5H2O2=2Mn2++5O2 ↑+8H2O
C.用铜做电极电解NaCl溶液:2C1—+2H2O H2↑+Cl2↑+2OH-
H2↑+Cl2↑+2OH-
D.将 Fe2O3 加入到 HI 溶液中:Fe2O3 + 6H+=2Fe3+ +3H2O
查看答案和解析>>
科目:高中化学 来源:2015-2016学年天津市高一下期中化学试卷(解析版) 题型:填空题
写出下列反应的化学方程式
(1)制备乙酸乙酯 ;
(2)实验室制作硝基苯 ;
(3)乙醇的催化氧化 ;
(4)铝热法炼铁反应 ;
查看答案和解析>>
科目:高中化学 来源:2015-2016学年天津市高一下期中化学试卷(解析版) 题型:选择题
下列有关元素的性质及其递变规律正确的是
A.IA族与ⅦA族元素间形成的化合物都是离子化合物
B.第三周期元素从左到右,最高正价从+1递增到+7
C.同主族元素的简单阴离子从上到下还原性减弱
D.同周期金属元素的化合价越高,其原子失电子能力越强
查看答案和解析>>
科目:高中化学 来源:2015-2016学年天津市高一下期中化学试卷(解析版) 题型:选择题
化学科学需要借助化学专用语言来描述,下列有关化学用语正确的是
A.原子核内有10个中子的氧原子
B.乙烯的结构简式为:C2H4
C.CH4分子的比例模型:
D.CO2的电子式: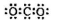
查看答案和解析>>
科目:高中化学 来源:2015-2016学年山西省高一下期中化学试卷(解析版) 题型:选择题
我国科学家通过测量SiO2中26Al和10Be两种元素的比例来确定“北京人”年龄,这种测量方法叫铝铍测年法.关于26Al和10Be的说法不正确的是
A.10Be和9Be是中子数不同质子数相同的不同原子
B.10Be的原子核内中子数比质子数多
C.5.2g 26Al3+中所含的电子数约为6.02×1024
D.26Al和26Mg的质子数、中子数和核外电子数均不相同
查看答案和解析>>
科目:高中化学 来源:2015-2016学年宁夏育才中学高一下期中化学试卷(解析版) 题型:选择题
下列递变规律正确的是( )
A.O、S、Na、K的原子半径依次增大
B.Na、Mg、Al、Si的还原性逐渐增强
C.HF、HCl、H2S、PH3的稳定性依次增强
D.KOH、Ca(OH)2、Mg(OH)2、Al(OH)3的碱性逐渐增强
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com