
科目:高中化学 来源: 题型:
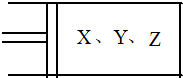 如图所示,将6mol X和3mol Y混合气体置于体积可变的等压容器中,在一定温度下发生如下反应:2X(g)+Y(g)?2Z(g).反应达到平衡状态A时,测得气体总物质的量为6.6mol.若X、Y、Z的起始物质的量分别用a.b.c表示,回答下列问题:
如图所示,将6mol X和3mol Y混合气体置于体积可变的等压容器中,在一定温度下发生如下反应:2X(g)+Y(g)?2Z(g).反应达到平衡状态A时,测得气体总物质的量为6.6mol.若X、Y、Z的起始物质的量分别用a.b.c表示,回答下列问题:查看答案和解析>>
科目:高中化学 来源: 题型:
| A、78g Na2O2与足量CO2充分反应时电子转移数为2NA |
| B、NA个氯气分子的体积为22.4L |
| C、4℃、101kPa时,54mL H2O中含有的分子数为3NA |
| D、1mol/L Na2SO4溶液中离子总数为3NA |
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
 硼酸钛[(TiO)2(B2O5)?4H2O]是一种高效节能润滑油添加剂,可用硫酸氧钛和硼砂的溶液为原料湿法合成.
硼酸钛[(TiO)2(B2O5)?4H2O]是一种高效节能润滑油添加剂,可用硫酸氧钛和硼砂的溶液为原料湿法合成.查看答案和解析>>
科目:高中化学 来源: 题型:
| A、向AlCl3溶液中滴加过量的氨水:Al3++4NH3?H2O=AlO2-+4NH4++2H2O |
| B、CaCO3与盐酸反应:CaCO3+2H+=Ca2++CO2↑+H2O |
| C、小苏打治疗胃酸过多:CO32-+2H+=CO2↑+2H2O |
| D、Cu片与浓硝酸反应:3Cu+8H++2NO3-=3Cu2++2NO↑+4H2O |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、生铁、不锈钢和黄铜都属于合金 |
| B、水泥、玻璃、陶瓷均属于无机非金属材料 |
| C、氧化钙、氧化镁、氧化铝都属于碱性氧化物 |
| D、溶液、胶体、浊液都属于分散系 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、仅④ | B、②和④ |
| C、③和④ | D、仅② |
查看答案和解析>>
科目:高中化学 来源: 题型:
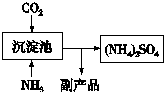
| ① |
| ② |
| ③ |
| ④ |
| 1 |
| 2 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com