
【题目】在三个容积均为1.0L的在恒容密闭容器中充入物质,发生反应:A(g)+B(g) ![]() 2D(g) 所得实验数据如下表:
2D(g) 所得实验数据如下表:
容器 | 温度/K | 物质的起始浓度/mol.L-1 | 平衡时物质的量浓度/mol.L-1 | ||
c(A) | c(B) | c(D) | c(D) | ||
Ⅰ | 400 | 0.20 | 0.20 | 0 | 0.080 |
Ⅱ | 600 | 0.40 | 0.10 | 0 | a |
Ⅲ | 600 | 0 | 0 | 0.40 | 0.20 |
请回答下列问题:
(1)该反应的正反应是吸热反应。判断的理由是_____________________________________________。
(2)在容器Ⅱ中,平衡时D物质的量浓度a=______________mol/L
(3)在保持容器Ⅲ的实验条件下,若起始时,A为0.40mol/L、B为0.20mol/L、D为0.40mol/L ,则达平衡时A的物质的量浓度为多少?(请写出解题过程) _______________
【答案】 若温度相同时,容器Ⅰ、Ⅲ中充入的物质是等效的,达平衡时D物质的浓度相同,但是实际上容器Ⅲ温度高且达平衡时D物质的浓度大于容器Ⅰ,说明温度升高,平衡向正反应方向移动,故正反应为吸热反应。或由表中数据可得400K时该反应的平衡常数K=1/4,600K时平衡常数K=4,可知温度越高平衡向正反应方向移动,故正反应为吸热反应 0.16 0.36mol/L。
【解析】(1)根据表中数据可知若温度相同时,容器Ⅰ、Ⅲ中充入的物质是等效的,达平衡时D物质的浓度相同,但是实际上容器Ⅲ温度高且达平衡时D物质的浓度大于容器Ⅰ,说明温度升高,平衡向正反应方向移动,故正反应为吸热反应。(2)由表中数据可得容器Ⅲ中600K平衡时D的浓度是0.20mol/L,消耗D是0.20mol/L,所以生成A和B均是0.10mol/L,则该温度下的平衡常数为![]() ;在容器Ⅱ中,平衡时D物质的量浓度amol/L,则消耗A和B均是0.5amol/L,则平衡时A和B的浓度分别是0.40mol/L-0.5amol/L、0.10mol/L-0.5amol/L,根据温度不变平衡常数不变可知
;在容器Ⅱ中,平衡时D物质的量浓度amol/L,则消耗A和B均是0.5amol/L,则平衡时A和B的浓度分别是0.40mol/L-0.5amol/L、0.10mol/L-0.5amol/L,根据温度不变平衡常数不变可知![]() ,解得a=0.16;(3)起始时,A为0.40mol/L、B为0.20mol/L、D为0.40mol/L,此时浓度熵=
,解得a=0.16;(3)起始时,A为0.40mol/L、B为0.20mol/L、D为0.40mol/L,此时浓度熵=![]() <K=4,所以反应向生成D的方向进行,设达平衡时发生转化的A物质的量浓度为xmol/L,则根据方程式可知
<K=4,所以反应向生成D的方向进行,设达平衡时发生转化的A物质的量浓度为xmol/L,则根据方程式可知
A(g)+B(g)![]() 2D(g)
2D(g)
起始浓度(mol/L)0.4 0.2 0.4
转化浓度(mol/L)x x 2x
平衡浓度(mol/L)0.4-x 0.2-x 0.4+2x
根据平衡常数可知
解得x=0.04
所以达平衡时A的浓度为0.4mol/L-x=0.36mol/L。


 开心蛙状元测试卷系列答案
开心蛙状元测试卷系列答案科目:高中化学 来源: 题型:
【题目】下表物质与其所含化学键类型、所属化合物类型完全正确的一组是( )
选项 | A | B | C | D |
物质 | MgCl2 | CO2 | HCl | NaOH |
所含化学键类型 | 离子键、共价键 | 共价键 | 离子键 | 离子键、共价键 |
所属化合物类型 | 离子化合物 | 共价化合物 | 离子化合物 | 共价化合物 |
A.AB.BC.CD.D
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】将氯化钠、氯化铝、氯化亚铁、氯化铁、氯化镁五种溶液,通过一步实验就能加以区别,并只用一种试剂,这种试剂是( )
A.KSCN
B.BaCl2
C.HCl
D.NaOH
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】英国曼彻斯特大学科学家安德烈·海姆和康斯坦丁·诺沃肖洛夫。共同工作多年的二人因“突破性地”用撕裂的方法成功获得超薄材料石墨烯而获奖。制备石墨烯方法有石墨剥离法、化学气相沉积法等。石墨烯的球棍模型示意图如下:

(1)下列有关石墨烯说法正确的是________________。
A.键长:石墨烯>金刚石
B.石墨烯分子中所有原子可以处于同一平面
C.12g石墨烯含![]() 键数为NA
键数为NA
D.从石墨剥离得石墨烯需克服石墨层与层之间的分子间作用力
(2)化学气相沉积法是获得大量石墨烯的有效方法之一,催化剂为金、铜、钴等金属或合金,含碳源可以是甲烷、乙炔、苯、乙醇或酞菁等中的一种或任意组合。
①铜原子在基态时,在有电子填充的能级中,能量最高的能级符号为_____________;第四周期元素中,最外层电子数与铜相同的元素还有________________________。
②乙醇的沸点要高于相对分子质量比它还高的丁烷,请解释原因______________________________。
③下列分子属于非极性分子的是__________________。
a.甲烷 b.二氯甲烷 c.苯 d.乙醇
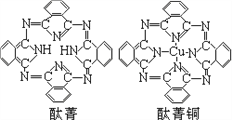
④酞菁与酞菁铜染料分子结构如图,酞菁分子中碳原子采用的杂化方式是__________;酞菁铜分子中心原子的配位数为________________。
⑤金与铜可形成的金属互化物合金(如图,该晶胞中,Au占据立方体的8个顶点):

它的化学式可表示为_____;在Au周围最近并距离相等的Cu有_____个,若2个Cu原子核的最小距离为d pm,该晶体的密度可以表示为___________________g/cm3。(阿伏伽德罗常数用NA表示)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列说法正确的是( )
A.摩尔是物质的质量的单位
B.氢气的摩尔质量是2g
C.1molOH﹣的质量是17g
D.气体摩尔体积约为22.4L/mol
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】(1)49 g H2SO4的物质的量是________;1.5 mol H2SO4的质量是_______,其中含有_______ mol H,含有_______g O。
(2)摩尔质量是指单位物质的量的物质所具有的质量。
①已知NH3的相对分子质量为17,则NH3的摩尔质量为________。
②NA为阿伏加德罗常数,已知a g某气体中含分子数为b,则该气体的摩尔质量为________。
③已知一个铁原子的质量为b g,则铁原子摩尔质量为________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某学生用已知物质的量浓度的盐酸来测定未知物质的量浓度的NaOH溶液时,选择甲基橙作指示剂。请填写下列空白。
(1)用标准的盐酸滴定待测的NaOH溶液时,左手握酸式滴定管的活塞,右手摇动锥形瓶,眼睛注视______________,直到因加入一滴盐酸后,溶液由________色变为________色,并________为止。
(2)下列操作中可能使所测NaOH溶液的浓度数值偏低的是__________。
A.酸式滴定管未用标准盐酸润洗就直接注入标准盐酸
B.滴定前盛放NaOH溶液的锥形瓶用蒸馏水洗净后没有干燥
C.酸式滴定管在滴定前有气泡,滴定后气泡消失
D.读取盐酸体积时,开始仰视读数,滴定结束时俯视读数
(3)若滴定开始和结束时,酸式滴定管中的液面如图所示,则起始读数为_______mL,终点读数为_______mL,所用盐酸溶液的体积为_______mL。

查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com