
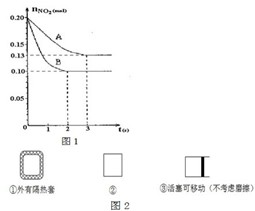
 在容积为VL的密闭容器中发生2NO2?2NO+O2反应.反应过程中NO2的物质的量随时间变化的状况如图1所示.
在容积为VL的密闭容器中发生2NO2?2NO+O2反应.反应过程中NO2的物质的量随时间变化的状况如图1所示.| c2(NO)?c(O2) |
| c2(NO2) |
| c2(NO)?c(O2) |
| c2(NO2) |
| 0.05mol | ||
|
| 0.025 |
| V |
| 0.025 |
| V |


 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案科目:高中化学 来源: 题型:
| A、2:1 | B、1:5 |
| C、2:3 | D、5:1 |
查看答案和解析>>
科目:高中化学 来源: 题型:
 MOH和ROH两种一元碱的溶液分别加水稀释时,pH变化如图 所示.下列叙述中不正确的是( )
MOH和ROH两种一元碱的溶液分别加水稀释时,pH变化如图 所示.下列叙述中不正确的是( )| A、MOH是一种弱碱 |
| B、在x点,c(M+)=c(R+) |
| C、在x点,ROH完全电离 |
| D、稀释前,c(ROH)=10 c(MOH) |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、稀硫酸与NaOH溶液反应2H++OH-=H2O |
| B、AgNO3溶液与NaCl溶液反应 Ag++Cl-=AgCl↓ |
| C、CaCO3与稀盐酸反应 CO32-+2H+=CO2↑+H2O |
| D、Fe片插入FeCl3溶液中 Fe+Fe3+=2Fe2+ |
查看答案和解析>>
科目:高中化学 来源: 题型:
| NaOH/H2O |
| NaOH/醇 |
| 加热 |
| 光照 |
| Br2 |
| NaOH/醇 |
| 加热 |
| 溴水 |
| NaOH/水 |
| 加热 |
| O2催化剂 |
| 加热 |
| O2催化剂 |
| 加热 |

查看答案和解析>>
科目:高中化学 来源: 题型:
| A、c(Na+)>c(CO32-)>c(HCO3-)>c(OH-) |
| B、c(Na+)+c(H+)=c(OH-)+c(HCO3-)+2c(CO32-) |
| C、c(Na+)=2[c(CO32-)+c(HCO3-)+c(H2CO3)] |
| D、c(OH-)=c(H+)+c(HCO3-)+2 c(H2CO3) |
查看答案和解析>>
科目:高中化学 来源: 题型:

查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com