
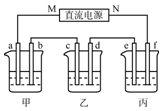
 如图所示装置中,甲、乙、丙三个烧杯依次分别盛放100g5%的NaOH溶液、足量的CuSO4溶液和10.00%的K2SO4溶液,电极均为石墨电极.
如图所示装置中,甲、乙、丙三个烧杯依次分别盛放100g5%的NaOH溶液、足量的CuSO4溶液和10.00%的K2SO4溶液,电极均为石墨电极.分析 乙为足量的CuSO4溶液,接通电源,经过一段时间后,乙中c电极质量增加,由此可知c为电解池的阴极,则d为阳极,M为负极,N为正极,a为阴极,
b为阳极,e为阴极,f为阳极;
(1)①由以上分析判断;
②甲电解过程中,a是阴极、b是阳极,阴极上水得电子生成氢气和OH-,b电极上OH-放电生成氧气;
③丙中为K2SO4,相当于电解水,设电解的水的质量为x.由电解前后溶质质量相等有,100×10%=(100-x)×10.47%,得x=4.5g,根据转移电子守恒计算b电极上生成气体体积;
④乙中c电极上析出Cu,析出铜的质量为电极质量变化,根据电子转移守恒计算;
⑤甲中实质上是电解水,溶质的质量不变、溶液质量减小,所以溶液的物质的量浓度增大;丙是电解水,硫酸钠是强酸强碱盐,其溶液物质的量浓度增大,但溶液仍然呈中性;
(2)如果电解过程中铜全部析出,溶液中溶质由硫酸铜转化为硫酸,仍然能进行电解.
解答 解:(1)①乙杯中c质量增加,说明Cu沉积在c电极上,电子是从b-c移动,M是负极,N为正极;
故答案为:正;
②甲中为NaOH,相当于电解H2O,阳极b处为阴离子OH-放电,即4OH--4e-=2H2O+O2↑,
故答案为:4OH--4e-=2H2O+O2↑;
③丙中为K2SO4,相当于电解水,设电解的水的质量为x.由电解前后溶质质量相等有,100×10%=(100-x)×10.47%,得x=4.5g,故为0.25mol.
由方程式2H2+O2═2H2O可知,生成2molH2O,转移4mol电子,所以整个反应中转化0.5mol电子,
电极b发生:4OH--4e-=2H2O+O2↑,
则生成O2为$\frac{0.5mol}{4}$=0.125mol,标况下的体积为0.125×22.4=2.8L,
故答案为:2.8;
④整个电路是串联的,所以每个烧杯中的电极上转移电子数是相等的,根据电极反应:Cu2++2e-=Cu,可知转移0.5mol电子生成的m(Cu)=$\frac{0.5}{2}$mol×64g/mol=16g.
故答案为:16;
⑤甲中相当于电解水,故NaOH的浓度增大,pH变大;乙中阴极为Cu2+放电,阳极为OH-放电,电解方程式为:2CuSO4+2H2O$\frac{\underline{\;通电\;}}{\;}$2Cu+O2↑+2H2SO4,所以H+增多,故pH减小;丙中为电解水,对于K2SO4而言,其pH几乎不变,
故答案为:丙;
(2)如果电解过程中铜全部析出,溶液中溶质由硫酸铜转化为硫酸,溶液中含有自由移动离子,硫酸能增大溶液导电性,所以仍然能进行电解,
故答案为:能;溶液中溶质由硫酸铜转化为硫酸,溶液中含有自由移动离子,硫酸能增大溶液导电性,所以仍然能进行电解.
点评 本题为电化学知识的综合应用,做题时要注意根据电极反应现象判断出电解池的阴阳级,进而判断出电源的正负极,要注意三个电解池为串联电路,各电极上得失电子的数目相等.做题时要正确写出电极方程式,准确判断两极上离子的放电顺序.


 优等生题库系列答案
优等生题库系列答案科目:高中化学 来源: 题型:选择题
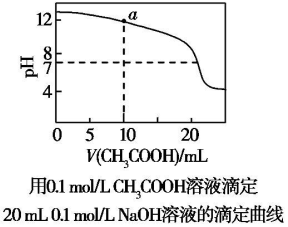
| A. | pH相等的CH3COONa、NaOH和Na2CO3三种溶液:c(CH3COONa)<c(Na2CO3)<c(NaOH) | |
| B. | H2A为弱酸,则0.1 mol.L-1NaHA溶液中:c(Na+)=2c(A2-)+c(HA-)+c(H2A) | |
| C. | 图中pH=7时:c(Na+)>c(CH3COO-)>c(OH-)=c(H+) | |
| D. | 上图中a点溶液:c(OH-)=c(H+)+c(CH3COO-)+2c(CH3COOH) |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 直径介于10-9m~10-7m之间的微粒称为胶体 | |
| B. | 明矾溶于水可产生具有吸附性的胶体粒子,常用于饮用水的杀菌消毒 | |
| C. | 用聚光手电筒照射NaCl溶液和Fe(OH)3胶体时,产生的现象不相同 | |
| D. | 将Fe(OH)3胶体和泥水分别进行过滤,发现均不能通过滤纸 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
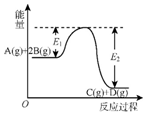
| A. | Q=E2 | |
| B. | 在反应体系中加入催化剂,反应速率增大,E1减小,E2不变 | |
| C. | Q>0,升高温度,正反应速率增大,逆反应速率减小 | |
| D. | 若减小体积,平衡会移动,当反应再次达到平衡时,A的平衡浓度增大 |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
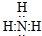 ,氯化铵
,氯化铵 .
.查看答案和解析>>
科目:高中化学 来源: 题型:实验题
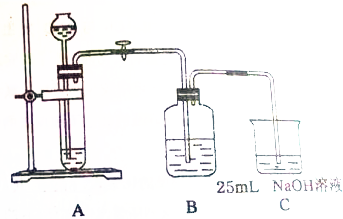 某同学拟用50mlNaOH溶液吸收CO2气体制备Na2CO3溶液.为了防止通入的CO2气体过量生产NaHCO3,他设计了如下实验步骤:
某同学拟用50mlNaOH溶液吸收CO2气体制备Na2CO3溶液.为了防止通入的CO2气体过量生产NaHCO3,他设计了如下实验步骤:查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 加入氯化钡溶液有白色沉淀产生,再加盐酸,沉淀不消失,一定有 SO42- | |
| B. | 某无色溶液中滴入紫色石蕊试液显红色,该溶液可能有 CO 32- | |
| C. | 加入碳酸钠溶液产生白色沉淀,再加盐酸白色沉淀消失,一定有 Ba2+ | |
| D. | 验证烧碱溶液中是否含有 Cl-,先加稍过量的稀硝酸除去 OH-,再加入 AgNO3溶液,如有 白色沉淀,则证明有 Cl- |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com