
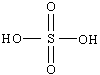
 、
、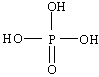 ,则它们的酸性
,则它们的酸性 期末宝典单元检测分类复习卷系列答案
期末宝典单元检测分类复习卷系列答案科目:高中化学 来源: 题型:阅读理解


| ||
| ||
查看答案和解析>>
科目:高中化学 来源:黑龙江省牡丹江一中2010-2011学年高二下学期期末考试化学试题 题型:058
(1)2003年夏,全球化学家投票评选了化学史上十项最美的实验,1848年巴斯德用手工在光学显微镜下把左型酒石酸盐晶体和右型酒石酸盐晶体分开的实验被选为十项之首.请回答下列问题:
a.左型酒石酸盐晶体和右型酒石酸盐晶体的关系是________.
b.下列化合物中具有与左,右型酒石酸盐的关系相同的是________.
(用序号表示)
①丙烯酸甲酯
②葡萄糖
③CHClBrCH2F2
④甘油
⑤2-氨基丙酸
⑥乳酸
(2)化学是一个美丽的学科,她向我们展示了微观世界中分子原子的规律.根据无机含氧酸的酸性规律,将下列四种无机含氧酸按酸性相近两两组成一组,它们是________和________,________和________.(用序号表示)
①H3PO4
②HClO
③H3BO3
④HNO2
(3)过渡元素可谓是藏龙卧虎,那里有熔点最高的钨,有贵重金属金,某元素的基态原子的正三价离子的3d能级为半充满状态.检验该离子常用试剂是________,反应的离子方程式为________,正三价离子外围电子排布图是________.钛被称为未来金属,钛的化合物TiCl3·6H2O(相对分子质量为262.5)配位数为6,取该晶体26.25克配成溶液,加入足量硝酸银溶液,过滤,洗涤,烘干,称重,沉淀为28.70克,则该晶体的化学式应表示为________.
(4)甲烷晶体晶胞结构如图,与一个甲烷分子紧密相邻的甲烷分子有________个.

查看答案和解析>>
科目:高中化学 来源: 题型:阅读理解
(16分)I、关于As的反应中,反应物与生成物有:AsH3、H2SO4、KBrO3、K2SO4、H3AsO4、H2O和一种未知物质X。
①已知KBrO3在反应中得到电子,则该反应的还原剂是 。
②已知0.2molKBrO3在反应中得到1mol电子生成X,则X的化学式为 。
③根据上述反应可推知 。(填序号)
A.氧化性:KBrO3>H3AsO4 B.氧化性:H3AsO4>KBrO3
C.还原性:AsH3>X D.还原性:X>AsH3
④在该反应中,氧化剂与还原剂的物质的量之比为 。
Ⅱ、X、Y、Z、W、L、M六种短周期主族元素的原子序数依次增大,其中X、M的单质在常温下呈气态,Y的原子最外层电子数是其电子层数的2倍,Z在同周期的主族元素中原子半径最大,W是地壳中含量最多的金属元素,L的单质晶体熔点高、硬度大,是一种重要的半导体材料。用化学用语回答下列问题:
(1)M在元素周期表中的位置为 。
(2)Y、L、M的最高价含氧酸的酸性由弱到强的顺序是 (写化学式)。
(3)原子序数比Y多2的元素的一种氢化物能分解为它的另一种氢化物,此分解反应的化学方程式是 。
(4)写出Z的最高价氧化物对应的水化物与单质W反应的离子方程式为
。
(5)R与Y同周期,R的单质分子R2中有3个共价键,R与L能形成一种新型无机非金属材料,其化学式是 。
(6)碘是人体必需的微量元素之一,有“智力元素”之称。我国从1989年开始,逐步以KIO3取代KI加工碘盐。已知在酸性溶液中可发生反应:![]() +5I-+6H+=3I2+3H2O,据此反应,可用试纸和一些生活中常见的物质设计实验,证明食盐中存在
+5I-+6H+=3I2+3H2O,据此反应,可用试纸和一些生活中常见的物质设计实验,证明食盐中存在 。可供选用的物质有:①自来水;②蓝色石蕊试纸;③碘化钾淀粉试纸;④淀粉;⑤食醋;⑥白酒;⑦食糖。你认为进行上述实验时必须使用的物质是 (填序号)。
。可供选用的物质有:①自来水;②蓝色石蕊试纸;③碘化钾淀粉试纸;④淀粉;⑤食醋;⑥白酒;⑦食糖。你认为进行上述实验时必须使用的物质是 (填序号)。
查看答案和解析>>
科目:高中化学 来源:2014届内蒙古高一下学期期中考试化学试卷(解析版) 题型:填空题
(12分)X、Y、Z、W、L、M六种短周期主族元素的原子序数依次增大,其中X、M的单质在常温下呈气态,Y的原子最外层电子数是其电子层数的2倍,Z在同周期的主族元素中原子半径最大,W是地壳中含量最多的金属元素,L的单质晶体熔点高、硬度大,是一种重要的半导体材料。 用化学用语回答下列问题:
(1)L的元素符号为___________;M在元素周期表中的位置为____________________。
(2)Y、L、M的最高价含氧酸的酸性由弱到强的顺序是_________________(写化学式)。
(3)原子序数比Y多2的元素的一种氢化物能分解为它的另一种氢化物,此分解反应的化学方程式是__________________ __。
(4)Z、W各自的最高价氧化物对应的水化物可以反应生成盐和水,该反应的离子方程式为________________________________________________________________。
(5)R与Y同周期,R的单质分子R2中有3个共价键,R与L能形成一种新型无机非金属材料,其化学式是___________________。
查看答案和解析>>
科目:高中化学 来源:同步题 题型:单选题
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com