
已知下列元素原子的最外层电子排布式,其中不能表示该元素一定为主族元素的是( )
A. 3s23p3 B. 4s2 C. 4s24p1 D. 3s23p5
 浙江名校名师金卷系列答案
浙江名校名师金卷系列答案科目:高中化学 来源:2016-2017学年吉林省高一上学期期末化学试卷(解析版) 题型:选择题
下列说法一定正确的是()
A.0.5mol Cl2所占体积约为11.2 L
B.16g O2中含有的分子数约为6.02×1023
O2中含有的分子数约为6.02×1023
C.0.1mol/L NaCl溶液中含溶质的物质的量为0.1mol
D.标准状况下,11.2 L N2和CO的混合气体所含原子数约 为6.02×1023
为6.02×1023
查看答案和解析>>
科目:高中化学 来源:2016-2017学年四川省乐山市高一上学期教学质检化学试卷(解析版) 题型:选择题
下列条件下,两物质所含分子数不相等的是 ( )
A.同温度、相同质量的N2和CO
B.常温常压,同体积的H2O和O2
C.同压强、同物质的量的N2和O2
D.同温度、同压强、同体积的N2O和CO2
查看答案和解析>>
科目:高中化学 来源:2016-2017学年四川省乐山市高二上学期教学质检化学试卷(解析版) 题型:选择题
在体积为VL的密闭容器中存在化学平衡:2NO2(g) N2O4(g),ΔH<0。保持温度不变,将容器体积压缩至V/2后,下列说法不正确的是( )
N2O4(g),ΔH<0。保持温度不变,将容器体积压缩至V/2后,下列说法不正确的是( )
A.容器内气体颜色变深 B.容器内NO2分子数减少
C.混合气体的平均相对分子质量增大 D.NO2的物质的量分数增大
查看答案和解析>>
科目:高中化学 来源:2016-2017学年四川省乐山市高二上学期教学质检化学试卷(解析版) 题型:选择题
三氯化磷分子的空间构型是三角锥形而不是平面正三角形。下列关于三氯化磷分子空间构型理由的叙述,正确的是:( )
A.PCl3分子中三个共价键的键长相等
B.PCl3分子中的P—Cl键属于极性共价键
C.PCl3分子中三个共价键的键长、键角均相等,
D.PCl3分子中P—Cl键的三个键的键长相等,且属于极性分子
查看答案和解析>>
科目:高中化学 来源:2016-2017学年山西省等三校高二上第二次联考化学试卷(解析版) 题型:填空题
氨气是工农业生产中不可或缺的物质,研究制取氨气的机理意义非凡。
(1)在常温、常压、光照条件下,N2在掺有少量Fe2O3的TiO2催化剂表面与水发生下列反应:
N2(g)+3H2O(l) 2NH3(g)+
2NH3(g)+ O2(g) △H=a kJ • mol-1 。
O2(g) △H=a kJ • mol-1 。
为进一步研究生成NH3的物质的量与温度的关系,常压下达到平衡时测得部分实验数据如下:
T/K | 303 | 313 | 323 |
n(NH3)/(l0-2 mol) | 4.8 | 5.9 | 6.0 |
此反应的a_________0,△S________0。(填“>”“<”或“ = ”)
(2)—定温度和压强下,在2 L的恒容密闭容器中合成氨气:N2(g)+3H2(g) 2NH3(g) △H=-92.4 kJ • mol-1。在反应过程中反应物和生成物的物质的量随时间的变化如图所示。
2NH3(g) △H=-92.4 kJ • mol-1。在反应过程中反应物和生成物的物质的量随时间的变化如图所示。
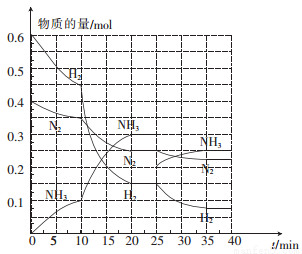
① 0~10 min内,以NH3表示的平均反应速率为_________。
② 在10~20 min内,NH3浓度变化的原因可能是_______。
A.加入催化剂 B.缩小容器体积 C.降低温度 D.增加NH3的物质的量
③ 在反应进行至25 min时,曲线发生变化的原因是____________,达到第二次平衡时,新平衡的平衡常数K2______K1(填“>”“<”或“ = ”)
查看答案和解析>>
科目:高中化学 来源:2016-2017学年山西省等三校高二上第二次联考化学试卷(解析版) 题型:选择题
将固体NH4I置于密闭容器中,在一定温度下发生下列反应:
①NH4I(s) NH3(g)+HI(g);
NH3(g)+HI(g);
②2HI(g) H2 (g)+I2(g);
H2 (g)+I2(g);
③2NH3(g) N2(g)+3H2 (g)。
N2(g)+3H2 (g)。
达到平衡时,c(H2) = 2 mol/L,c(N2)=0.5mol/L ,c(HI)=4mol/L,则平衡时 NH3的浓度为
A 0.5 mol • L-1 B.2 mol • L-1 C.4 mol • L-1 D.5 mol • L-1
查看答案和解析>>
科目:高中化学 来源:2016-2017学年湖南省等三校高一12月联考化学卷(解析版) 题型:实验题
某学生欲配制6.0 mol/L的H2SO4480 mL,实验室有三种不同浓度的硫酸:①240mL 1.0 mol/L的硫酸; ②20 mL 25%的硫酸(ρ=1.18 g/mL); ③足量的18 mol/L的硫酸。老师要求把①②两种硫酸全部用完,不足的部分由③来补充。
请回答下列问题:
(1)实验所用25%的硫酸的物质的量浓度为______mol/L(保留1位小数)。
(2)配制该硫酸溶液应选用容量瓶的规格为______mL。
(3)配制时,该同学的操作顺序如下,请将操作步骤 B、D 补充完整。
A.将①②两溶液全部在烧杯中混合均匀;
B.用量筒准确量取所需的18 mol/L 的浓硫酸________mL,沿玻璃棒倒入上述混合液中。并用玻璃棒搅拌,使其混合均匀;
C.将混合均匀的硫酸沿玻璃棒注入所选的容量瓶中;
D.____________________________;
E.振荡,继续向容量瓶中加水,直到液面接近刻度线1~2 cm处;
F.改用胶头滴管加水,使溶液的凹液面恰好与刻度线相切;
G.将容量瓶盖紧,振荡,摇匀。
(4)如果步骤C中的硫酸溶液未冷却就转移到容量瓶并定容,对所配溶液浓度有何影响?____________(填“偏大”、“偏小”或“无影响”下同)。如果省略步骤 D,对所配溶液浓度有何影响?________________。
查看答案和解析>>
科目:高中化学 来源:2017届福建省宁德市高三上学期单科质检模拟化学试卷(解析版) 题型:选择题
从海带中提取碘的实验过程中,下列操作正确的是( )
A. 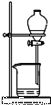 放出碘的苯溶液
放出碘的苯溶液
B. 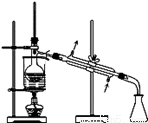 分离碘并回收苯
分离碘并回收苯
C. 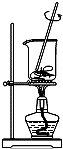 将海带灼烧
将海带灼烧
D. 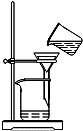 过滤含I-溶液
过滤含I-溶液
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com