
分析 无色溶液可知一定不含Cu2+,
①取少量该试样溶液加入过量的氢氧化钡溶液,充分反应后过滤,得到沉淀1和溶液1,沉淀1为硫酸钡或氢氧化镁;
②向沉淀1中加入过量盐酸,沉淀部分溶解,则沉淀1为硫酸钡和氢氧化镁,原溶液中一定含Mg2+、SO42-;.
③向溶液1中通入适量二氧化碳气体,充分反应后过滤,得到沉淀2和溶液2,则溶液1中含过量氢氧化钡,沉淀2可能为碳酸钡;
④向沉淀2中加入过量盐酸,沉淀溶解并放出气体,则沉淀2中碳酸钡可完全溶解生成气体,且沉淀2可能含氢氧化铝;
⑤另取少量该试样溶液进行焰色反应实验,透过蓝色钴玻璃片观察到紫色火焰,可知原溶液一定含K+,以此来解答.
解答 解:(1)由上述分析可知,原溶液中一定含K+ Mg2+ SO42-,故答案为:K+ Mg2+ SO42-;
(2)由上述分析可知,不能确定的离子为Al3+、Cl-,故答案为:Al3+、Cl-;
(3)该试样溶液中一定不存在的离子有Cu2+,故答案为:Cu2+.
点评 本题考查常见离子的推断,为高频考点,把握离子之间的反应、现象为解答的关键,侧重分析与推断能力的考查,注意氢氧化钡、盐酸均过量,题目难度不大.


 孟建平小学滚动测试系列答案
孟建平小学滚动测试系列答案科目:高中化学 来源: 题型:选择题
| A. | 称量时,将NaOH固体放在右盘,砝码放在左盘 | |
| B. | 将NaOH固体在烧杯中溶解,所得的溶液冷却至室温后,再转移到容量瓶中 | |
| C. | 转移液体时,可以不用将洗涤液转至容量瓶 | |
| D. | 定容时,可以俯视刻度线读数 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
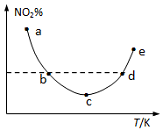 取5等份(各1mol)NO2,分别加入温度不同的2L恒容密闭容器中,发生反应:2NO2(g)?N2O4(g).反应10s时,分别测定体系中NO2的百分含量(NO2%),并作出其随反应温度(T)变化的关系图.据图分析,下列说法正确的是( )
取5等份(各1mol)NO2,分别加入温度不同的2L恒容密闭容器中,发生反应:2NO2(g)?N2O4(g).反应10s时,分别测定体系中NO2的百分含量(NO2%),并作出其随反应温度(T)变化的关系图.据图分析,下列说法正确的是( )| A. | 图中a、b两点对应的反应未达到平衡状态 | |
| B. | 图中b、d两点对应的NO2速率相等 | |
| C. | 该反应为吸热反应 | |
| D. | e点对应的容器中气体颜色最深 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| 弱酸化学式 | HX | HY | H2CO3 |
| 电离平衡常数 | 7.8×10-9 | 3.7×10-15 | K1=4.3×10-7 K2=5.6×10-11 |
| A. | pH相同的HX、HY溶液,HY的物质的量浓度小 | |
| B. | 相同条件下溶液的碱性:NaX>Na2CO3>NaY>NaHCO3 | |
| C. | 结合H+的能力:Y->CO32->X->HCO3- | |
| D. | 向NaX溶液中通入CO2的化学方程式:2NaX+CO2+H2O=Na2CO3+2HX |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | W、Y、R的简单离子半径依次增大 | |
| B. | X、R、Z都可与Y形成两种化合物 | |
| C. | X2Y的热稳定性强于X2R、沸点也高于X2R,但解释的理由不相同 | |
| D. | Z元素分别与X元素和Y元素形成的化合物都是离子晶体,均能与水反应且一定生成了强碱和无色气体 |
查看答案和解析>>
科目:高中化学 来源: 题型:计算题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 钠在氯气中燃烧产生白色烟雾 | |
| B. | 红热的铜丝可以在氯气中燃烧,产生棕黄色烟雾 | |
| C. | 纯净的氢气可以在氯气中安静地燃烧,发出苍白色火焰 | |
| D. | 氯气可用于漂白,这是氯气的漂白作用 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | Al(OH)3→Al2O3 | B. | SiO2→H2SiO3 | C. | Al→AlO2- | D. | Si→Na2SiO3 |
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com