
| A. | HCl和NaOH反应的中和热△H=-57.3kJ/mol,则H2SO4和Ca(OH)2反应的中和热为2×(-57.3)kJ/mol | |
| B. | 500℃、30MPa下,将0.5molN2和1.5mol H2置于密闭容器中充分反应生成NH3(g),放热19.3kJ,其热化学方程式为:N2(g)+3H2(g) $?_{500℃、30MPa}^{催化剂}$2NH3(g)△H=-38.6kJ•mol-1 | |
| C. | CO(g)的燃烧热是283.0 kJ/mol,则表示CO燃烧热的热化学方程式为CO(g)+$\frac{1}{2}$O2(g)═CO2 (g)△H=-283.0 kJ/mol | |
| D. | 需要加热才能发生的反应一定是吸热反应 |
分析 A.生成硫酸钙放热;
B.合成氨为放热反应,热化学方程式中为完全转化的能量变化;
C.1molCO完全燃烧放出的热量为燃烧热;
D.吸热反应与放热反应与反应条件无关.
解答 解:A.生成硫酸钙放热,则HCl和NaOH反应的中和热△H=-57.3kJ/mol,则测定的H2SO4和Ca(OH)2反应的中和热小于2×(-57.3)kJ/mol,故A错误;
B.合成氨为放热反应,热化学方程式中为完全转化的能量变化,由0.5molN2和1.5mol H2置于密闭容器中充分反应生成NH3(g),放热19.3kJ,可知热化学方程式为:N2(g)+3H2(g) $?_{500℃、30MPa}^{催化剂}$2NH3(g)△H<-38.6kJ•mol-1,故B错误;
C.1molCO完全燃烧放出的热量为燃烧热,则表示CO燃烧热的热化学方程式为CO(g)+$\frac{1}{2}$O2(g)═CO2 (g)△H=-283.0 kJ/mol,故C正确;
D.吸热反应与放热反应与反应条件无关,常温下发生的反应可能为吸热反应,如氢氧化钡与氯化铵的反应,故D错误;
故选C.
点评 本题考查热化学方程式,为高频考点,把握反应中能量变化、中和热与燃烧热为解答的关键,侧重分析与应用能力的考查,注意选项A为易错点,题目难度不大.


科目:高中化学 来源: 题型:选择题
| A. | 食品包装时放入盛有还原铁粉的透气小袋可防止食品氧化变质 | |
| B. | 聚乙烯、聚氯乙烯均可作为包装材料,且不会造成环境污染 | |
| C. | 华为自主研发的“麒麟”芯片与光导纤维是同种材料 | |
| D. | 小苏打能作焙制蛋糕的膨松剂是由于小苏打能与碱反应生成CO2 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 胶体是一种液态混合物,属于分散系的一种 | |
| B. | 用丁达尔效应可区分Fe(OH)3胶体、水、CuSO4溶液 | |
| C. | 用过滤器可以将胶体和溶液分开 | |
| D. | 胶体的本质特征是发生丁达尔效应 |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
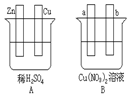 按要求对图中两极进行必要的联接并填空:
按要求对图中两极进行必要的联接并填空:查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 实验室用氯酸钾制氧气结束时,先从水槽中移出导气管,再熄灭酒精灯 | |
| B. | 蒸馏操作时,应使温度计水银球靠近蒸馏烧瓶的支管口处 | |
| C. | 分液操作时,分液漏斗中下层液体从下口放出,上层液体从上口倒出 | |
| D. | 由于碘在酒精中的溶解度大,所以可用酒精把碘水中的碘萃取出来 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | HCl+Zn,Zn+NaHSO4 | B. | Cu(OH)2+H2SO4,Cu(OH)2+HNO3 | ||
| C. | CaO+HCl,CaO+HNO3 | D. | BaCl2+NaHSO4,Ba(OH)2+NaHSO4(少量) |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 用苯萃取溴水中的溴时,将溴的苯溶液从分液漏斗下口倒出 | |
| B. | 使用容量瓶的第一步操作是先将容量瓶用蒸馏水洗涤后烘干 | |
| C. | 与金属反应时,稀HNO3被还原为NO,而浓HNO3被还原为NO2,故稀硝酸的氧化性强于浓硝酸 | |
| D. | 用10 mL量筒量取9.2 mL NaCl溶液 |
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
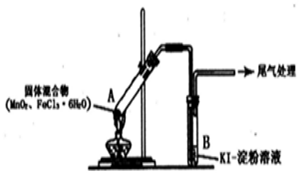
| 实验编号 | 操作 | 现象 |
| 实验1 | 按上图所示加热MnO2与FeCl3•6H2O 混合物 | ①试管A中部分固体溶解,上方出现白雾 ②稍后,产生黄色气体,管壁附着黄色液滴 ③试管B中溶液变蓝 |
| 实验2 | 把A中的混合物换为FeC13•6H2O,B中溶液换为KSCN溶液,加热. | A中部分固体溶解,产生白雾和黄色气体,B中KSCN溶液变红 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com