
【题目】用化学方法除去下列物质中混有的少量杂质,其中括号内为杂质,写出除杂需加入的试剂(用化学式表示)以及发生反应的离子方程式。
(1)固体Na2CO3(NaHCO3)除杂发生反应的化学方程式___;
(2)固体Fe(OH)3(Al(OH)3)除杂发生反应的离子方程式____;
(3)溶液FeCl2(CuCl2)除杂发生反应的离子方程式____;
(4)气体CO2(HCl)除杂发生反应的离子方程式___。
【答案】2NaHCO3![]() Na2CO3+H2O +CO2↑ Al(OH)3+OH-=AlO2-+2H2O Fe+Cu2+=Fe2++Cu HCO3-+H+=H2O+CO2↑
Na2CO3+H2O +CO2↑ Al(OH)3+OH-=AlO2-+2H2O Fe+Cu2+=Fe2++Cu HCO3-+H+=H2O+CO2↑
【解析】
(1)碳酸氢钠受热分解生成碳酸钠;
(2)氢氧化铝可与强碱反应生成偏铝酸钠;
(3)铁能置换出氯化铜中的金属铜;
(4)HCl与饱和碳酸氢钠反应生成二氧化碳;
(1)碳酸氢钠受热分解生成碳酸钠,则利用加热法除杂,发生的反应为:2NaHCO3![]() Na2CO3+H2O +CO2↑,
Na2CO3+H2O +CO2↑,
故答案为:2NaHCO3![]() Na2CO3+H2O +CO2↑;
Na2CO3+H2O +CO2↑;
(2)Fe(OH)3与氢氧化钠不反应,氢氧化铝可与强碱反应生成偏铝酸钠,可用氢氧化钠溶液除杂,发生反应的离子方程式Al(OH)3+OH-=AlO2-+2H2O,
故答案为:Al(OH)3+OH-=AlO2-+2H2O;
(3)铁能置换出氯化铜中的金属铜,反应为:Cu2++Fe=Cu+Fe2+,然后过滤即可得到氯化亚铁,
故答案为:Fe;Cu2++Fe=Cu+Fe2+;
(4)HCl与饱和碳酸氢钠反应生成二氧化碳,则除杂试剂为碳酸氢钠,发生的离子反应为HCO3-+H+═CO2↑+H2O,
故答案为:HCO3-+H+═CO2↑+H2O。


 备战中考寒假系列答案
备战中考寒假系列答案科目:高中化学 来源: 题型:
【题目】海水开发利用的部分过程如图所示,下列说法错误的是

A.粗盐可采用除杂和重结晶等过程提纯
B.向苦卤中通入Cl2是为了提取溴
C.实际生产中常选用Ca(OH)2作为沉淀剂
D.工业生产中电解氯化镁溶液的方法制取镁
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】一定温度下在一定体积的密闭容器中,下列叙述不能作为可逆反应A(g)+3B(g) ![]() 2C(g)达到平衡状态标志的是 ( )
2C(g)达到平衡状态标志的是 ( )
①C的生成速率与C的消耗速率相等
②单位时间内生成a mol A,同时生成3a mol B
③A、B、C的浓度不再变化
④C的物质的量不再变化
⑤混合气体的总压强不再变化
⑥混合气体的总物质的量不再变化
⑦单位时间消耗a mol A,同时生成3a mol B
⑧A、B、C的分子数之比为1∶3∶2
A. ②⑧B. ④⑦C. ①③D. ⑤⑥
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】高能锂离子电池总反应式为2Li+FeS=Fe+Li2S,LiPF6·SO(CH3)2为电解质,用该电池为电源电解含镍酸性废水并得到单质Ni的实验装置如图所示。下列说法正确的是
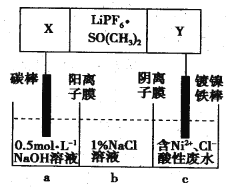
A. LiPF6·SO(CH3)2可用Li2SO4水溶液代替
B. 当转移1mol e-时,b室离子数增加NA个
C. 该电池充电时阳极反应式为Fe+Li2S-2e-=FeS+2Li+
D. 若去除图阴离子膜,则电解反应总方程式发生改变
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】关于Na2CO3与NaHCO3的性质判断正确的是( )
A.常温下溶解度:Na2CO3<NaHCO3
B.热稳定性:Na2CO3<NaHCO3
C.与同浓度同体积的盐酸反应的速率:Na2CO3>NaHCO3
D.与澄清石灰水反应,均有白色沉淀生成
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列变化不可能通过一步反应直接完成的是
A. Al(OH)3 → Al2O3 B. Al2O3 → Al(OH)3
C. Al → AlO2- D. Al3+ → Al(OH)3
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】相同质量的镁和铝分别与足量盐酸反应产生的氢气体积比是___;相同体积的镁和铝分别与足量盐酸反应产生的氢气较多的是___;相同物质的量的镁和铝分别与足量盐酸反应产生的氢气体积比是___。(镁的密度:1.738g/cm3,铝的密度:2.70g/cm3)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】矿业废水中Al3+含量的测定和处理是环境保护的重要课题。
(1)向矿业废水中加入NaOH溶液至沉淀不再溶解,再加入一定量的NaHCO3溶液搅拌,反应生成丝钠铝石[NaAl(OH)2CO3]沉淀,过滤除去。写出加入NaHCO3溶液生成丝钠铝石沉淀的离子方程式:____________________________________。
(2) 为确定加入NaHCO3溶液的量,需测定矿业废水中Al3+的含量。工业上常采用EDTA络合滴定法,步骤如下:
步骤1:CuSO4标准液的配制与标定。取一定量胆矾溶于水,加入适量稀H2SO4,转移到1 L容量瓶中定容。准确量取25.00 mL所配溶液置于250 mL锥形瓶中,用0.005 0 mol·L-1EDTA标准液滴定至终点。重复3次实验,平均消耗EDTA标准液10.00 mL 。
步骤2:样品分析。取10.00 mL矿业废水置于250 mL锥形瓶中,加入一定体积柠檬酸,煮沸;再加入0.005 0 mol·L-1的EDTA标准液20.00 mL,调节溶液pH至4.0,加热;冷却后用CuSO4标准液滴定至终点,消耗CuSO4标准液30.00 mL。(已知:Cu2+、Al3+与EDTA反应的化学计量比均为1∶1)
步骤1中,重复3次实验的目的是____________________________。
② Fe3+也可与EDTA反应,步骤2中加入的柠檬酸是作为掩蔽剂,消除Fe3+的干扰。若该矿业废水样品中含有Fe3+,而上述实验中未加入柠檬酸,则测定的Al3+含量将________(填“偏大”“偏小”或“无影响”)。
③计算该矿业废水中Al3+的含量____________(用mg·L-1表示)(写出计算过程)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】以某含镍废料(主要成分为NiO,还含有少量FeO、Fe2O3、CoO、SiO2等)为原料制备NixOy和碳酸钻的工艺流程如下:
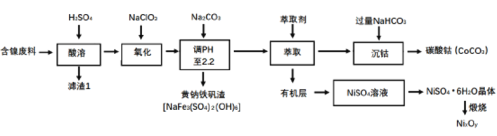
(1)“酸溶”时需将含镍废料粉碎,目的是___;含有CoCO3的玻璃常用作实验室观察钾元素的焰色反应,该玻璃的颜色为____。
(2)“氧化”中添加NaClO3的作用是____,为证明添加NaClO3已足量,可用____ (写化学式)溶液进行检验。
(3)“调pH”过程中生成黄钠铁钒沉淀(NaFe3(SO4)2(OH)6),其离子方程式为_____。
(4)“沉钴”过程的离子方程式__。若“沉钴钻”开始时c(Co2+)=0.10 mol/L,则控制pH≤__时不会产生Co(OH)2沉淀。(已知Ksp[Co(OH)2]=4.0×10-15,lg2=0.3)。
(5)从NiSO4溶液获得NiSO4·6H2O晶体的操作依次是:加热浓缩溶液至有晶膜出现,_____,过滤,洗涤,干燥。“锻烧”时剩余固体质量与温度变化曲线如图,该曲线中B段所表示氧化物(NixOy)的化学式为____。

查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com