
| 174 |
| 149 |
| x |
| y |
| 149x |
| 174 |
| 149x |
| 174 |
| 25.6-17.4 |
| 25.6 |


科目:高中化学 来源: 题型:
| A、使用明矾净水的好处是杀菌、消毒,吸附水中的悬浮物 |
| B、减少使用氟氯代烃的目的是为了减少酸雨 |
| C、大量开采地下水,矿产资源,以满足社会经济发展的需求 |
| D、氢燃料汽车的使用,可以有效减少城市空气污染 |
查看答案和解析>>
科目:高中化学 来源: 题型:
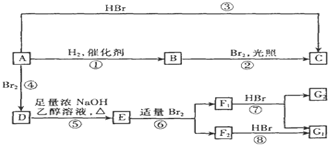 (D是
(D是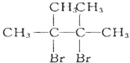 )
)查看答案和解析>>
科目:高中化学 来源: 题型:

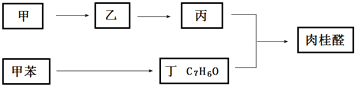
查看答案和解析>>
科目:高中化学 来源: 题型:

| Cl2/H2O |
查看答案和解析>>
科目:高中化学 来源: 题型:
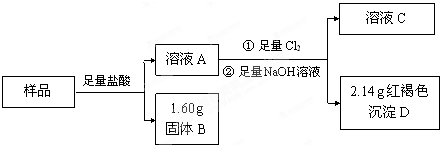
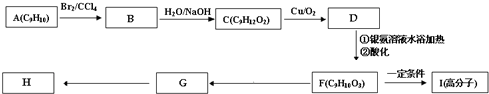
查看答案和解析>>
科目:高中化学 来源: 题型:
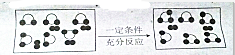 假设一定条件下某密闭容器中存在如图所示反应(空心球代表X原子,实心球代表Y原子),下列有关该反应的说法中不正确的是( )
假设一定条件下某密闭容器中存在如图所示反应(空心球代表X原子,实心球代表Y原子),下列有关该反应的说法中不正确的是( )| A、该反应一定是可逆反应 |
| B、该反应一定是氧化还原反应 |
| C、该反应一定是放热反应 |
| D、该反应的方程式可表示为2XY2+Y2?2XY3 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、酸性溶液中:CO32- SO42- Fe2+ Na+ |
| B、强碱性溶液中:Cl- NO3- Ba2+ K+ |
| C、无色澄清透明的溶液中:MnO4- Al3+ SO42- K+ |
| D、PH=7的溶液中:Fe3+ Cl- Al3+ NO3- |
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com