
分析 (1)无色溶液中不可能存在有颜色的离子;
(2)加入过量稀盐酸,有白色沉淀生成,再加入过量稀硝酸,沉淀不消失,说明含有Ag+;
(3)能和NaOH溶液反应生成白色沉淀的离子是Mg2+;
(4)溶液中一定含银离子,与银离子结合生成沉淀的不能存在.
解答 解:(1)有颜色的离子不用做实验就能判断是否存在,溶液无色说明不含Cu2+、Fe3+,故答案为:Cu2+、Fe3+;
(2)加入过量稀盐酸,有白色沉淀生成,再加入过量稀硝酸,沉淀不消失,说明含有Ag+,离子反应方程式为:Ag++Cl-=AgCl↓,故答案为:Ag+;Ag++Cl-=AgCl↓;
(3)能和NaOH溶液反应的离子是Mg2+,离子反应方程式为Mg2++2OH-═Mg(OH)2↓,故答案为:Mg2++2OH-═Mg(OH)2↓;
(4)原溶液中存在Ag+,则Cl- 不能共存,原溶液中肯定有Mg2+,故CO32-、OH-不能与其共存,硝酸根离子不与所给的任何离子生成沉淀,故溶液中可能大量存在的离子是硝酸根,故选B.
点评 本题主要考查的是离子的检验,为高频考点,根据离子的颜色、离子之间的反应来分析解答,知道铁离子、亚铁离子、硫酸根离子、氯离子、铵根离子的检验方法及现象,题目难度不大.


 中考利剑中考试卷汇编系列答案
中考利剑中考试卷汇编系列答案 教育世家状元卷系列答案
教育世家状元卷系列答案 黄冈课堂作业本系列答案
黄冈课堂作业本系列答案 单元加期末复习先锋大考卷系列答案
单元加期末复习先锋大考卷系列答案科目:高中化学 来源: 题型:选择题
| A. | 6.0gSiO2晶体中存在的共价键总数为2 NA | |
| B. | 1L 0.1mol•L-1的Na2CO3溶液中含有阳离子的总数为2NA | |
| C. | 标准状况下,2.0gD2O中含有的质子数和中子数均为NA个 | |
| D. | 室温时,pH=12的Ba(OH)2溶液中,氢氧根离子数目为10-2N |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| 目的 | 操作 | |
| A | 干燥Cl2 | 将气体通过盛有碱石灰的干燥装置 |
| B | 检验溴乙烷中的溴元素 | 取样,加NaOH溶液,振荡后再加AgNO3溶液 |
| C | 测定混有NaCl的Na2CO3固体样品中Na2CO3的质量分数 | 取m1g样品加入过量盐酸充分反应,加热蒸干后,称量固体质量为m2 g |
| D | 配制100mL 1.0mol•L-1 CuSO4溶液 | 将25g CuSO4•5H2O溶于100mL蒸馏水中 |
| A. | A | B. | B | C. | C | D. | D |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | X的原子序数一定为a+2 | |
| B. | Y离子的结构示意图可表示为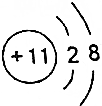 | |
| C. | 若b-a=6.则X和Y形成的化合物一定为离子化合物 | |
| D. | X有可能是非金属元素 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 化学材料的研发和使用,为开发太阳能资源,寻求经济发展的新动力提供有力支撑.请根据你所学知识回答:
化学材料的研发和使用,为开发太阳能资源,寻求经济发展的新动力提供有力支撑.请根据你所学知识回答:查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 某醋酸溶液的pH=a.将此溶液稀释10倍后,溶液的pH值为b.则b=a+1 | |
| B. | CH3OOH和CH3COONa混合溶液不可能存在:c (CH3COOH)>c (CH3COO-)>c (H+)>c (Na+)>c (0H-) | |
| C. | 常温下.将pH=3的H2SO4和pH=11的一元碱BOH-溶液等体积混合,所得溶液可能为中性或酸性 | |
| D. | 常溫下,浓度均为O.1mol•L-1的①CH3COOH溶液②NaOH溶液③CH3OONa 溶液中,水的电离程度③>①>② |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 最外层电子数:E>F | |
| B. | 等物质的量的E和F分别与足量稀盐酸反应,产生氢气的物质的量:E>F | |
| C. | Ea+和Fb+有相同的电子层结构(a<b) | |
| D. | 25℃时,Ksp[E(OH)a]>Ksp[F(OH)b] |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 常温下,22gCO2含碳氧双键数目为2NA | |
| B. | 12.0gNaHSO4固体中含阳离子数为0.1NA | |
| C. | 标准状况下,22.4LBr2中所含分子数为NA | |
| D. | 7.8gNa2O2与足量的水反应转移电子数为0.2NA |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com