
(15分)CO和NO是汽车尾气的主要污染物。消除汽车尾气的反应式之一为:
2NO(g)+2CO(g) N2(g)+2CO2(g)。请回答下列问题:
N2(g)+2CO2(g)。请回答下列问题:
(1)已知:N2(g)+O2(g)=2NO(g) △H= +180.5kJ/mol ①
C(s)+O2(g)=CO2(g) △H= -393.5kJ/mol ②
2C(s)+O2=2CO(g) △H= -221kJ/mol ③
则 2NO(g) + 2CO(g) N2(g) + 2CO2(g)△H= 。
N2(g) + 2CO2(g)△H= 。
(2)-定温度下,在一体积为VL的密闭容器中充人一定量的NO和CO时,反应进行到t时刻时达到平衡状态,此时n(CO)=amol、n(NO)=2amol、n(N2)=bmol,且N2占平衡混合气体总体积的1/4。
①该反应的平衡常数K= (用只含a、V的式子表示)。
②判断该反应达到平衡的标志是____(填序号)
A.v(CO2)生成=v(CO)消耗
B.混合气体的平均相对分子质量不再改变
C.混合气体的密度不再改变
D.NO、CO、N2、CO2的物质的量浓度均不再变化
(3)在一定温度下,将2.0molNO、2.4molCO通入固定容积2L的密闭中,反应过程中部分物质的物质的量变化如图所示,则:

①有害气体NO的转化率是 ,0~15minCO2的平均反应速率v(CO2)=____。
②20min时,若改变反应条件,导致CO浓度减小,则改变的条件是 (填序号)。
A.增加CO的量 B.加入催化剂
C.降低温度 D.扩大容积体积
(4)通过NOx传感器可监测NOx的含量,其工作原理如图所示,
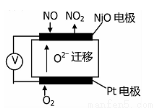
则:
①Pt电极上发生的是 反应(填“氧化”或“还原”);
②NiO电极上的电极反应式为 。
(1)△H=—746.5kJ/mol (2)①27V/a ②BD (3)①40% 0.027mol/(L·min) ②CD
(4)①还原 ②NO—2e—+O2—=NO2
【解析】
试题分析:(1)已知:N2(g)+O2(g)=2NO(g) △H=+180.5kJ/mol ①,C(s)+O2(g)=CO2(g) △H=-393.5kJ/mol ②, 2C(s)+O2=2CO(g) △H=-221kJ/mol ③,则根据盖斯定律可知②×2—③—①即可得到2NO(g) + 2CO(g) N2(g) + 2CO2(g) △H=—746.5kJ/mol。
N2(g) + 2CO2(g) △H=—746.5kJ/mol。
(2)①平衡时n(CO)=amol、n(NO)=2amol、n(N2)=bmol,则根据方程式可知生成CO2是2bmol。又因为N2占平衡混合气体总体积的1/4,所以平衡时混合气体的总的物质的量是4b,则4bmol=bmol+2bmol+amol+2amol,解得b=3a。化学平衡常数是在一定条件下,当可逆反应达到平衡状态时,生成物浓度的幂之积和反应物浓度的幂之积的比值,所以该反应的平衡常数K= 。
。
②在一定条件下,当可逆反应的正反应速率和逆反应速率相等时(但不为0),反应体系中各种物质的浓度或含量不再发生变化的状态,称为化学平衡状态。A.v(CO2)生成=v(CO)消耗,均表示正反应速率,所以不能说明反应达到平衡状态,A错误;B.混合气的平均相对分子质量是混合气的质量和混合气的总的物质的量的比值,质量不变,但物质的量是变化的,因此混合气体的平均相对分子质量不再改变可以说明反应达到平衡状态,B正确;C.密度是混合气的质量和容器容积的比值,在反应过程中质量和容积始终是不变的,因此密度始终是不变的,则混合气体的密度不再改变不能说明反应达到平衡状态,C错误;D.NO、CO、N2、CO2的物质的量浓度均不再变化说明正逆反应速率相等,反应达到平衡状态,D正确,答案选BD。
(3) ①平衡时CO是1.6mol,则消耗CO是2.4mol—1.6mol=0.8mol,所以根据方程式可知消耗NO是0.8mol,因此有害气体NO的转化率是 ;生成CO2是0.8mol,浓度是0.4mol/L,所以0~15minCO2的平均反应速率v(CO2)=0.4mol/L÷15min=0.027mol/(L·min)。
;生成CO2是0.8mol,浓度是0.4mol/L,所以0~15minCO2的平均反应速率v(CO2)=0.4mol/L÷15min=0.027mol/(L·min)。
②A.增加CO的量,CO浓度增大,A错误;B.加入催化剂平衡不移动,CO浓度不变,B错误;C.正方应是放热反应,降低温度平衡向正反应方向进行,CO浓度减小,C正确;D.扩大容积体积平衡向逆反应方向进行,当CO浓度仍然减小,D正确,答案选CD。
(4)①Pt电极上通入氧气,则Pt电极是正极,发生还原反应。
②NiO电极是负极,NO失去电子转化为NO2,所以该电极上的电极反应式为NO—2e—+O2—=NO2。
考点:考查盖斯定律应用、平衡状态判断、计算以及外界条件对平衡状态的影响和原电池应用


 名校课堂系列答案
名校课堂系列答案科目:高中化学 来源:2014-2015学年云南省弥勒市高三市统测一模理综化学试卷(解析版) 题型:选择题
下表中各组物质之间不能通过一步反应实现下图转化的是

甲 | 乙 | 丙 | |
A | AlCl3 | Al(OH)3 | Al2O3 |
B | SiO2 | H2SiO3 | Na2SiO3 |
C | Cl2 | HCl | NaCl |
D | CH2=CH2 | CH3CH2Cl | CH3CH2OH |
查看答案和解析>>
科目:高中化学 来源:2014-2015学年江苏省镇江市高三第一学期期末调研测试化学试卷(解析版) 题型:选择题
下列有关实验装置(部分夹持装置已省略)进行的相应实验,能达到实验目的的是
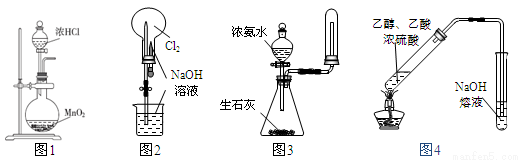
A.用图1所示装置可制取Cl2
B.用图2所示装置可完成“喷泉”实验
C.用图3所示装置可制取并收集干燥纯净的NH3
D.用图4所示装置可用于实验室制取乙酸乙酯
查看答案和解析>>
科目:高中化学 来源:2014-2015学年江苏省苏州市高三上学期期末调研测试化学试卷(解析版) 题型:选择题
用铜片、银片、Cu(NO3)2溶液、AgNO3溶液、导线和盐桥(盛有KNO3琼脂的U型管)构成一个原电池。以下有关该原电池的叙述正确的是

① 在外电路上,电流由铜电极流向银电极
② 正极反应为:Ag++e―=Ag
③ 盐桥中的NO3-移向AgNO3溶液,K+移向Cu(NO3)2溶液
④ 将铜片浸入AgNO3溶液中发生的化学反应与该原电池反应相同
A.①② B.②③ C.②④ D.③④
查看答案和解析>>
科目:高中化学 来源:2014-2015学年江苏省苏州市高三上学期期末调研测试化学试卷(解析版) 题型:选择题
下列物质性质与相应结果或应用的对应关系正确的是
A.酸性越强的含氧酸跟铁片反应产生氢气越快
B.将草木灰和硫铵混合施用,可使肥效更高
C.Mg(OH)2和Al(OH)3受热易分解,常用它们作阻燃剂
D.某地雨水经过一段时间,其pH由4.68降为4.28,因为水中溶解了较多的CO2
查看答案和解析>>
科目:高中化学 来源:2014-2015学年湖南省郴州市高三第二次月考理综化学试卷(解析版) 题型:选择题
甲苯的苯环上有5个氢原子,其中若有两个氢原子分别被羟基(-OH)和氯原子(-Cl)取代,则可形成的有机物同分异构体有:
A.9种 B.10种 C.12种 D.15种
查看答案和解析>>
科目:高中化学 来源:2014-2015学年湖北省荆州市部分县市高三上学期期末统考理综化学试卷(解析版) 题型:填空题
[化学—选修2化学与技术](15分)
空气吹出法工艺是目前“海水提溴”的最主要方法之一,其工艺流程如下:

(1)目前,从海水中提取的溴约占世界溴年产量的 。
(2)步骤①中用硫酸酸化可提高Cl2的利用率,其原因是 。
(3)步骤④的离子方程式为 。
(4)步骤⑥的蒸馏过程中,溴出口温度要控制在8090℃。温度过高或过低都不利于生产,理由是 。
(5)步骤⑧中溴蒸气冷凝后得到液溴与溴水的混合物,可利用它们的相对密度相差较大的特点进行分离。分离仪器的名称是 ,分离时液溴从分离器 (填“上口”或“下口")排出。
(6)不直接用含溴的海水进行蒸馏得到液溴,而要经过“空气吹出、S02吸收、氯化”的原因是 。
(7)某同学测得苦卤中溴的含量为0.8g/L,已知步骤①⑥中溴共损失了25%,步骤⑦和步骤⑧又共损失了所得溴蒸气的10%,若处理10 m3这样的苦卤,可得到液溴 mol。
查看答案和解析>>
科目:高中化学 来源:2014-2015学年河南省南阳市高三上学期期末理综化学试卷(解析版) 题型:选择题
将CO2持续通入下列八种饱和溶液:①Na2CO3 ②K2SiO3 ③Na[Al(OH)4] ④K2SO3
⑤Ca(ClO)2 ⑥BaCl2和NH3 ⑦NH3和NaCl ⑧Ca(OH)2,最终能够得到沉淀或析出晶体的是
A.②⑤⑥⑧ B.③④⑤⑧ C.①④⑥⑦ D.①②③⑦
查看答案和解析>>
科目:高中化学 来源:2014-2015学年福建省泉州市高三上学期期末化学试卷(解析版) 题型:选择题
下列有关化学用语使用正确的是
A.氯原子的结构示意图:
B.CO2分子的比例模型:
C.具有10个中子的氧原子:
D.乙烯的结构简式:C2 H4
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com