
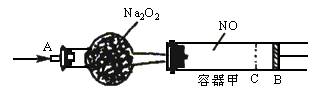
(1)①已知当活塞移至C处时,干燥管中物质的质量增加了2.24g。此时,通入标准状况下的CO2气体为多少升?容器甲中NO2转化为N2O4的转化率是多少?___________________。
②活塞移至C处后,继续通入amol CO2,此时活塞恰好回至B处。则a值必小于0.01,其理由是_____________。
(2)若改变干燥管中Na2O2的量,可通过调节甲容器的温度及通入CO2的量,使活塞发生从B到C,又从C到B的移动。则Na2O2的质量最小值应大于______________g。
科目:高中化学 来源: 题型:
 随时间变化如图所示.
随时间变化如图所示.| c(C)×c(D) |
| c(A)×c2(B) |
| c(C)×c(D) |
| c(A)×c2(B) |
| 2.44 |
| t1 |
| 2.44 |
| t1 |
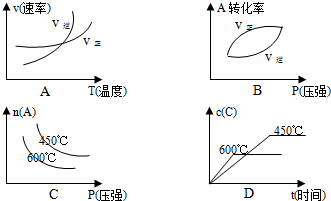 题意,下列曲线符合变化规律的是
题意,下列曲线符合变化规律的是查看答案和解析>>
科目:高中化学 来源: 题型:
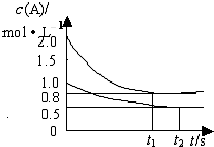 向甲乙两个容积均为1L的恒容容器中,分别充入2molA、2molB和1molA、1molB.相同条件下,发生下列反应:A(g)+B(g)?xC(g);△H<0.测得两容器中c(A)随时间t的变化如图所示,下列说法正确的是( )
向甲乙两个容积均为1L的恒容容器中,分别充入2molA、2molB和1molA、1molB.相同条件下,发生下列反应:A(g)+B(g)?xC(g);△H<0.测得两容器中c(A)随时间t的变化如图所示,下列说法正确的是( )查看答案和解析>>
科目:高中化学 来源: 题型:
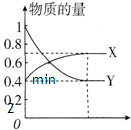 在一定温度下,体积为2L的密闭容器中,NO2和N2O4之间发生反应:N2O4(g)
在一定温度下,体积为2L的密闭容器中,NO2和N2O4之间发生反应:N2O4(g) 2NO2 (g),如图所示.
2NO2 (g),如图所示.查看答案和解析>>
科目:高中化学 来源: 题型:
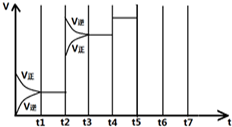 在一定条件下发生化学反应:2SO2(g)+O2(g)?2SO3(g)△H=-197kJ/mol.现有容积均为1L的甲、乙两个容器,在上述条件下分别充入气体,到达平衡时,反应放出的热(Q),及平衡时的转化率(X)如下表所示:
在一定条件下发生化学反应:2SO2(g)+O2(g)?2SO3(g)△H=-197kJ/mol.现有容积均为1L的甲、乙两个容器,在上述条件下分别充入气体,到达平衡时,反应放出的热(Q),及平衡时的转化率(X)如下表所示:| 容器 | 起始时各物质的量 | 到达平衡时放出的热量(QkJ) | 平衡时SO2转化率 (X) | |||
| SO2 | O2 | SO3 | N2 | |||
| 甲 | 2 | 1 | 0 | 0 | Q1 | X1 |
| 乙 | 1 | 0.5 | 0 | 1 | Q2= 39.4 |
X2 |
| t 1-t 2 | t 3-t 4 | t 4-t 5 | t 6-t 7 |
| K1 | K2 | K3 | K4 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com