
| A. | C5H10O2 | B. | C5H10O5 | C. | C6H6O | D. | C6H12O6 |
分析 含碳元素 40%,含氢元素 6.7%,其余为氧元素,则氧元素的含量为1-40%-6.7%=53.3%,又知摩尔质量为 150g/mol,可计算各种元素的质量,计算1mol有机物含有的C、H、O的物质的量,可确定分子式,以此解答该题.
解答 解:含碳元素 40%,含氢元素 6.7%,其余为氧元素,则氧元素的含量为1-40%-6.7%=53.3%,又知摩尔质量为 150g/mol,
则1mol有机物
n(C)=$\frac{150×40}{12}$=5,
n(H)=$\frac{150×6.7%}{1}$=10,
n(O)=$\frac{150×53.3%}{16}$=5,
则分子式为C5H10O5,
故选B.
点评 本题考查有机物分子式的确定,为高频考点,侧重考查学生的分析能力和计算能力,注意把握有机物分子式的确定方法,难度不大.


 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:选择题
| A. | 有无色、刺激气味气体产生 | |
| B. | 有白色沉淀生成 | |
| C. | 有红褐色沉淀生成 | |
| D. | 有白色沉淀生成,很快变成灰绿色,最后变为红褐色 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 物质的摩尔质量等于其相对分子(原子)质量 | |
| B. | “物质的量”是国际单位制中的一个基本单位 | |
| C. | 0.012kg 12C中所含的碳原子数为NA | |
| D. | 1 mol任何物质都含有约6.02×1023个原子 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 0.1mol•L-1 | B. | 0.3mol•L-1 | C. | 0.2mol•L-1 | D. | 0.4mol•L-1 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 羰基硫与烧碱溶液反应生成水和两种正盐的离子方程式为COS+4NaOH=Na2S+Na2CO3+2H2O羰基硫的脱硫常用两种方法,其反应式分别为:
羰基硫与烧碱溶液反应生成水和两种正盐的离子方程式为COS+4NaOH=Na2S+Na2CO3+2H2O羰基硫的脱硫常用两种方法,其反应式分别为:| 化学键 | C=O(CO2) | C=O(COS) | C=S | H-S | H-O |
| 键能(kJ/mol) | 803 | 742 | 577 | 339 | 465 |
| 容器 | 甲 | 乙 |
| 反应物投入量 | 1molCO2、3molH2 | mmolCO2、3mmolH2、 nmolCH3OH(g)、nmolH2O(g) |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| 实验 | 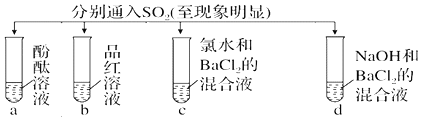 | ||||
| 现象 | A | 无色 | 无色 | 无现象 | 无色溶液 |
| B | 红色 | 无色 | 白色沉淀 | 白色沉淀 | |
| C | 无色 | 无色 | 溶液变无色,白色沉淀 | 白色沉淀 | |
| D | 无色 | 无色 | 无色溶液 | 无色溶液 | |
| A. | A | B. | B | C. | C | D. | D |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
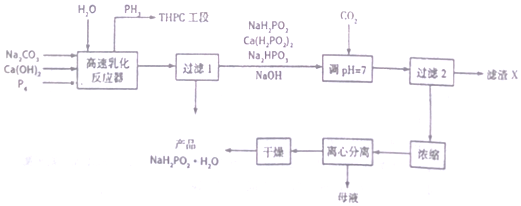
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 标准状况下,1.12L CCl4含有的共价键数为0.2NA | |
| B. | 常温常压下,2.3g NO2和N2O4的混合物中含有的氧原子数为0.2NA | |
| C. | 过氧化钠与水反应时,生成0.lmol氧气转移的电子数为0.2NA | |
| D. | 常温下,0.1mol•L-1溶液中阴离子总数大于0.1NA |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 在含有大量[Al(OH)4]-的溶液中:NH4+、Na+、Cl-、H+ | |
| B. | 含有大量Fe3+的溶液中:Na+、Mg2+、I-、SCN- | |
| C. | pH=13的溶液中:K+、NH4+、SO42-、NO3- | |
| D. | 由水电离产生的c(OH-)=1×10-12mol•L-1的溶液中:K+、Na+、Cl-、NO3- |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com