
| 1 | 2 | 3 | 4 | 5 | 6 | 7 | 8 |
| CH4 | C2H4 | C3H8 | C4H8 | C6H12 | C7H16 | C8H16 |
| A. | 7 | B. | 8 | C. | 9 | D. | 10 |
分析 根据表格中物质的化学式的规律,可知5号物质为C5H12.再根据碳链异构体判断同分异构体,最后通过氢原子的种类等于一氯代物种数来判断含有一氯代物的同分异构体总数.
解答 解:根据表中烃分子式的排列规律可知,5号物质为戊烷,C5H12有正戊烷、异戊烷、新戊烷3种同分异构体:CH3CH2CH2CH2CH3、CH3CH2CH(CH3)CH3、C(CH3)4,
CH3CH2CH2CH2CH3分子中含有3种氢原子,一氯代物种数是3;
CH3CH2CH(CH3)CH3分子中含有4种氢原子,一氯代物种数是4;
C(CH3)4分子中含有1种氢原子,一氯代物种数是1;
所以戊烷的一氯代物总共有8种同分异构体,
故选B.
点评 本题考查同分异构体的书写、归纳与整理的能力,题目难度中等,注意对比化学式发现物质组成所存在的规律是关键,易错点是等效氢的判断方法.


 名校课堂系列答案
名校课堂系列答案科目:高中化学 来源: 题型:解答题
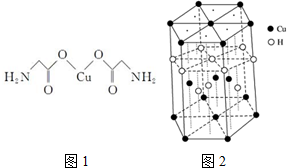
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
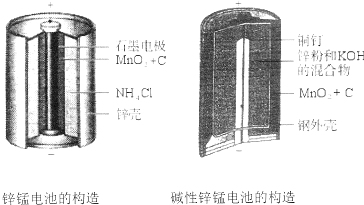
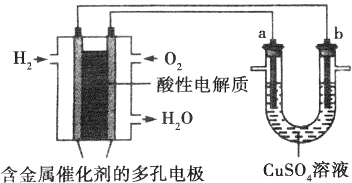
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 等质量的聚乙烯(PE)和乙烯完全燃烧消耗氧气的量相等 | |
| B. | 废弃的PE和PVC均可回收利用以减少白色污染 | |
| C. | 将PVC薄膜放入试管中加强热,产生的气体可使湿润的蓝色石蕊试纸变红 | |
| D. | PVC的单体可由PE的单体与氯化氢加成制得 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
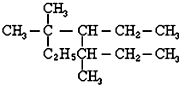 的名称是3,3,5-三甲基-4-乙基庚烷.
的名称是3,3,5-三甲基-4-乙基庚烷.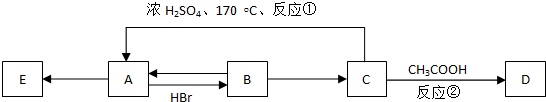
 .
.查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| 选项 | 实 验 操 作 | 结 论 |
| A | 用容量瓶配制溶液时,若定容摇匀后液面低于刻度线,补加水至与刻度线相平 | 所配溶液浓度不受影响 |
| B | 用湿润的pH试纸测定氯水的pH | 所测溶液的pH偏大 |
| C | 取少量试液于试管中,加入浓NaOH溶液并加热,用湿润的红色石蕊试纸检验产生的气体 | 若红色石蕊试纸变蓝 则所取溶液含NH4+ |
| D | 用托盘天平称取一定质量的NaCl固体,左盘放砝码,右盘放固体 | 所称NaCl质量一定偏小 |
| A. | A | B. | B | C. | C | D. | D |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
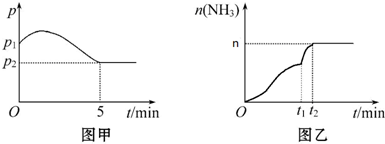
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| 选项 | 实验操作 | 现象 | 结论 |
| A | 将0.1mol•L-1MgSO4溶液滴入NaOH溶液至不再有沉淀产生,再滴加0.1mol•L-1CuSO4溶液 | 先有白色沉淀生成后变为蓝色沉淀 | Cu(OH)2的Ksp比Mg(OH)2的小 |
| B | 用洁净铂丝蘸取溶液进行焰色反应 | 火焰呈黄色 | 原溶液中有Na+,无K+ |
| C | 向盛Na2SiO3 溶液的试管中滴加1滴酚酞,然后逐滴加入稀盐酸至红色褪去 | 2min后,试管里出现凝胶 | 非金属性:Cl>Si |
| D | 向蔗糖中加入浓硫酸 | 蔗糖变成疏松多孔的海绵状碳 | 浓硫酸具有吸水性和强氧化性 |
| A. | A | B. | B | C. | C | D. | D |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com