
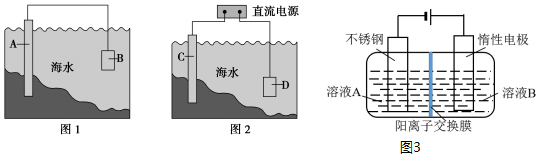
分析 (1)形成原电池时,Fe作正极被保护;活泼性比Fe强的金属作负极,被腐蚀;
(2)Fe作阴极被保护,保护钢闸门C的方法叫外加电流的阴极保护法;阳极上氯离子失电子生成氯气,检验氯气用湿润的淀粉碘化钾试纸;
(3)因为阳极氢氧根失电子发生氧化反应,又2CrO42-+2H+?Cr2O72-+H2O,所以溶液B是铬酸钾(K2CrO4)溶液,产物在阳极生成;依据原子守恒、电子守恒计算.
解答 解:(1)形成原电池时,Fe作正极被保护,则要选择活泼性比Fe强的金属作负极,所以选锌,故答案为:c;
(2)Fe作阴极被保护,保护钢闸门C的方法叫外加电流的阴极保护法;电解氯化钠溶液时阳极D上氯离子失电子生成氯气,其电极反应为:2Cl--2e-═Cl2↑,检验氯气用湿润的淀粉碘化钾试纸,即用湿润的淀粉碘化钾试纸放在阳极D附近,试纸变蓝,证明生成氯气;
故答案为:外加电流的阴极保护;湿润的淀粉碘化钾试纸放在阳极D附近,试纸变蓝,证明生成氯气;
(3)因为阳极氢氧根失电子发生氧化反应,又2CrO42-+2H+?Cr2O72-+H2O,所以溶液B是铬酸钾(K2CrO4)溶液,产物在阳极生成;
设加入反应容器内的K2CrO4为1mol,反应过程中有xmol K2CrO4转化为K2Cr2O7,则阳极区剩余K2CrO4为(1-x)mol,对应的n(K)=2(1-x)mol,n(Cr)=(1-x)mol,生成的K2Cr2O7为$\frac{x}{2}$mol,对应的n(K)=xmol,n(Cr)=xmol,根据测定混合液中K与Cr的物质的量之比为6:5,则$\frac{2(1-x)+x}{1-x+x}$=6:5,解得x=0.8,转化率为 $\frac{0.8}{1}$×100%=80%,故答案为:K2CrO4溶液;阳极;80%.
点评 本题考查了原电池原理和电解池原理的分析应用,把握原电池原理和电解池原理以及电解过程中电子守恒的计算应用,掌握基础是关键,题目难度中等.


科目:高中化学 来源: 题型:选择题
| A. | 向pH相同的氨水和氢氧化钠溶液中分别加入适量NH4Cl(s)后,两溶液的pH均减小 | |
| B. | 将Ca(OH)2的饱和溶液加热,pH 和 Ksp均增大 | |
| C. | 25℃时pH=11的NaOH,当温度升高到80℃时,其pH不变 | |
| D. | 用CH3COOH 溶液做导电性实验,灯泡很暗,能证明CH3COOH 是弱电解质 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 苯乙烷(C8H10)可生产塑料单体苯乙烯(C8H8),其反应原理是C8H10(g)$\frac{\underline{\;△\;}}{\;}$C8H8(g)+H2(g)△H=+125kJ•mol-1
苯乙烷(C8H10)可生产塑料单体苯乙烯(C8H8),其反应原理是C8H10(g)$\frac{\underline{\;△\;}}{\;}$C8H8(g)+H2(g)△H=+125kJ•mol-1| 时间/min | 0 | 10 | 20 | 30 | 40 |
| n(C8H10)/mol | 0.40 | 0.30 | 0.26 | n2 | n3 |
| n(C8H8)/mol | 0.00 | 0.10 | n1 | 0.16 | 0.16 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 某课外活动小组同学用图1装置进行实验,试回答下列问题:
某课外活动小组同学用图1装置进行实验,试回答下列问题:查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 乙酸与水能以任意比例互溶 | |
| B. | 乙酸溶液的导电性弱 | |
| C. | 10 mL1 mol•L-1乙酸恰好与10 mL1 mol•L-1NaOH溶液完全反应 | |
| D. | 1 mol•L-1的乙酸溶液的C(H+)约为0.01 mol•L-1 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 气态氢化物的稳定性:W>Z | |
| B. | 简单离子半径:X<Y | |
| C. | 液态ZW4气化需克服分子间作用力 | |
| D. | X、W可以同时出现在同一离子化合物中 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
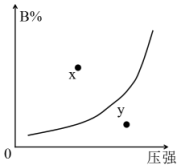 在一定温度下,反应mA(s)+nB(g)?pC(g)△H<0,B的体积分数(B%)与压强变化的关系如图所示,下列叙述中正确的是( )
在一定温度下,反应mA(s)+nB(g)?pC(g)△H<0,B的体积分数(B%)与压强变化的关系如图所示,下列叙述中正确的是( )| A. | m+n>P | |
| B. | x点表示该反应的正反应速率小于逆反应速率 | |
| C. | n<p | |
| D. | x点比y点时的反应速率快 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com