
【题目】有关下列反应产物的叙述不正确的是( )
A. 在Cl2中点燃铁丝,有FeCl2生成
B. 将Cl2通入水中,有HCl生成
C. 将Cl2通入NaBr溶液中,有Br2生成
D. 将Cl2通入NaOH溶液中,有NaClO生成
 新思维假期作业暑假吉林大学出版社系列答案
新思维假期作业暑假吉林大学出版社系列答案 蓝天教育暑假优化学习系列答案
蓝天教育暑假优化学习系列答案科目:高中化学 来源: 题型:
【题目】下列说法正确的是( )
A. 用如图装置电解精炼镁
用如图装置电解精炼镁
B. 用如图装置验证试管中铁丝发生析氢腐蚀
用如图装置验证试管中铁丝发生析氢腐蚀
C. 如图装置中Mg作负极,Al作正极
如图装置中Mg作负极,Al作正极
D. 用如图装置对二次电池进行充电
用如图装置对二次电池进行充电
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某有机化合物X(C7H8O)与另一有机化合物Y发生如下反应生成化合物Z(C11H14O2):![]()
(1)X是下列化合物之一,已知X不能与FeCl3溶液发生显色反应,则X是(填字母)。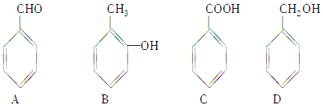
(2)Y的分子式是 , 可能的结构简式是和。
(3)Y有多种同分异构体,其中一种同分异构体E发生银镜反应后,其产物经酸化可得到F(C4H8O3)。F可发生如下反应:![]()
该反应的类型是 , E的结构简式是。
(4)若Y与E具有相同的碳链,则Z的结构简式为?
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】质量为9.7g 的Cu、Zn合金与足量的稀HNO3反应,还原产物只有NO气体,其体积在标准状况下为2.24L,将溶液稀释为1L,测得溶液的pH=1,此时溶液中NO3﹣的浓度为( )
A.0.3 molL﹣1
B.0.4 molL﹣1
C.0.5 molL﹣1
D.0.6 molL﹣1
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】5.76g部分氧化的Fe、Cu合金样品(氧化产物为Fe2O3、CuO),经如下处理,下列说法正确的是( ) 
A.V=224
B.样品中Fe的质量为2.14 g
C.未氧化前Fe元素的质量分数约为41.2%
D.样品中CuO的质量为3.52 g
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某研究性学习小组以不纯的氧化铝(含Fe2O3杂质)为原料,设计了冶炼铝的工艺流程(部分反应产物没有标出): 
(1)试剂X的化学式为 , 反应Ⅰ的离子方程式是 . 实验室配制480mL 1molL﹣1的X溶液必须用到的玻璃仪器除烧杯、玻璃棒、胶头滴管外,还有 .
(2)通入过量的M、N的化学式分别为、 , 反应Ⅱ、Ⅳ的离子方程式分别为 .
(3)按照方案设计,试剂Z的作用是调节溶液的pH为3.1,以生成沉淀b[Fe(OH)3].试剂Z可选用(填选项字母).
A.Al2O3
B.H2SO4
C.NaOH
D.Al(OH)3 .
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】人体内有20多种微量元素,它们质量总和不到体里的千万分之,但是对人的健康却起着重要作用,下列各组元素全部是微量元素的是( )
A. K、CL、S、OB. Mn、Fe、Zn、Cu
C. N、H、P、CD. K、Ca、C、Mg
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】2Na2CO33H2O2是一种新型的氧系漂白剂.某实验兴趣小组进行了如下实验.
Ⅰ.实验制备
实验原理:2Na2CO3+3H2O2═2Na2CO33H2O2
实验步骤:取3.5g Na2CO3溶于10mL H2O,加入0.1g稳定剂,用磁力搅拌器搅拌完全溶解后,将6.0mL 30%H2O2在15min内缓慢加入到三颈烧瓶中,实验装置如图.反应1小时后,加入1g氯化钠后,静置结晶,然后抽滤,干燥一周后,称重.
(1)装置中球形冷凝管的作用是 . 使用冷水浴的作用是 .
(2)加入适量NaCl固体的原因是 .
(3)2Na2CO33H2O2极易分解,其反应方程式可表示为 .
(4)Ⅱ.活性氧含量测定
准确称取试样0.2000g,置于250mL锥形瓶中,加100mL浓度为6%的硫酸溶液,用0.0200mol/LKMnO4标准溶液滴定,记录KMnO4标准溶液消耗的体积为32.70mL.活性氧含量计算公式:Q%=(40cV/m)×100%[c:KMnO4标准溶液浓度(mol/L);V:消耗的KMnO4标准溶液体积(L);m:试样质量(g)]滴定终点的判断依据为 . 活性氧含量为 .
(5)Ⅲ.产品纯度的测定
为了测定产品中2Na2CO33H2O2的质量分数,设计了几种方案,涉及不同的反应原理.
方案一 将试样与MnO2混合均匀,向混合物中滴加水,测生成气体的体积,进而进行计算.
方案二 .
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】电石中的碳化钙和水能完全反应:CaC2+2H2O═C2H2↑+Ca(OH)2使反应产生的气体排水,测量排出水的体积,可计算出标准状况乙炔的体积,从而可测定电石中碳化钙的含量.
(1)若用下列仪器和导管组装实验装置:
序号 | 1 | 2 | 3 | 4 | 5 | 6 |
导管及仪器 |
|
|
|
|
|
|
每个橡皮塞上都打了两个孔 | ||||||
如果所制气体流向从左向右时,上述仪器和导管从左到右直接连接的顺序(填各仪器、导管的序号)是:接接接接接 .
(2)仪器连接好后,进行实验时,有下列操作(每项操作只进行一次):
①称取一定量电石,置于仪器3中,塞紧橡皮塞.
②检查装置的气密性.
③在仪器6和5中注入适量水.
④待仪器3恢复到室温时,量取仪器4中水的体积(导管2中的水忽略不计).
⑤慢慢开启仪器6的活塞,使水逐滴滴下,至不发生气体时,关闭活塞.
正确的操作顺序(用操作编号填写)是 .
(3)若实验产生的气体有难闻的气味,且测定结果偏大,这是因为电石中含有杂质.
(4)若实验时称取的电石1.60g,测量排出水的体积后,折算成标准状况乙炔的体积为448mL,此电石中碳化钙的质量分数是 %.
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com