
 新编小学单元自测题系列答案
新编小学单元自测题系列答案科目:高中化学 来源: 题型:解答题
| 化学键 | C-C | C-H | C一O | Si-Si | Si-H | Si一O |
| 键能/(kJ•mol-1) | 356 | 413 | 336 | 226 | 318 | 452 |
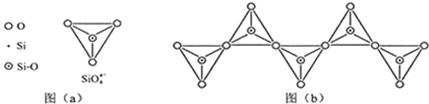
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 该溶液中,K+、Mg2+、NH3•H2O、Cl-可以大量共存 | |
| B. | 与足量Ba(OH)2溶液反应的离子方裎式:Fe2++SO42-+Ba2++2OH-=Fe(OH)2↓+BaSO4↓ | |
| C. | (NH4)2Fe(SO4)2溶液久置空气中变质的离子方程式:12Fe2++3O2+6H2O=4Fe(OH)3↓+8Fe3+ | |
| D. | 向该溶液中滴加适量的酸性KMnO4溶液使其恰好反应溶液褪为无色 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
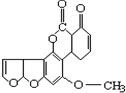
| A. | 1mol该化合物最多消耗H2和NaOH分别为6 mol和2 mol | |
| B. | 该化合物中含有三种官能团 | |
| C. | 该化合物中含有2个苯环结构 | |
| D. | 该化合物可以和1mol Br2发生加成反应 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | X与Y形成的两种化合物中阴、阳离子的个数比均为1:2,且均能与水反应 | |
| B. | 根据非金属性强弱,不可能由Z的最高价氧化物制出W的最高价氧化物 | |
| C. | Y的简单氢化物的沸点和热稳定性均大于R的简单氢化物 | |
| D. | 向两份BaCl2溶液中分别通入RY2、WY2,均无白色沉淀生成,但一段时间后,通入RY2的一份中可能产生沉淀 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
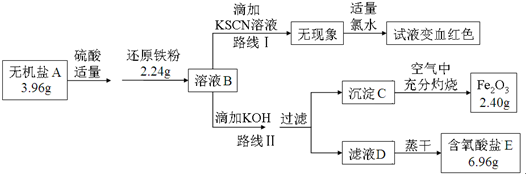
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| 编号 | 实验操作 | 实验目的或结论 |
| A | 向某有机物中加入新制Cu(OH)2悬浊液并加热,有砖红色沉淀 | 该有机物一定是醛 |
| B | 将CH3CH2Br与NaOH溶液混合加热,再滴加AgNO3溶液,未产生浅黄色沉淀 | 证明CH3CH2Br未发生水解 |
| C | 分别给乙醇和苯酚溶液中加入紫色石蕊试液,观察其颜色的变化 | 比较乙醇和苯酚的酸性强弱 |
| D | 用pH试纸测定CH3COONa溶液的pH | 证明CH3COOH是弱电解质 |
| A. | A | B. | B | C. | C | D. | D |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
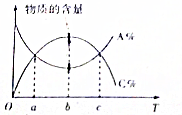 对于反应mA+nB?pC,在其它条件不变时,A与C两物质的物质的量随温度的变化情况如图所示,则下列说法正确的是( )
对于反应mA+nB?pC,在其它条件不变时,A与C两物质的物质的量随温度的变化情况如图所示,则下列说法正确的是( )| A. | 该反应为吸热反应 | |
| B. | 在a,c时刻,正逆反应速率相等 | |
| C. | 若横轴为压强,则存在m+n<p | |
| D. | b时刻正逆反应速率大于c时刻的正逆反应速率 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com