
分析 合金溶于过量盐酸铁和铝反应,剩余固体质量为硅的质量,计算得到n(Si),加入过量氢氧化钠溶液铝离子反应全部变化为偏铝酸钠,铁离子生成氢氧化铁过滤、洗涤得固体.再将所得固体充分加热、灼烧,得红棕色粉末1.60g为Fe2O3,计算得到铁元素物质的量,结合质量守恒计算合金中铝元素物质的量得到化学式.
解答 解:准确称取1.46g该合金粉末,加入过量盐酸溶液,充分反应后过滤,铁和铝全部溶解,测定剩余固体质量0.07g为硅,n(Si)=$\frac{0.07g}{28g/mol}$=0.0025mol,
向滤液中滴加足量NaOH浓溶液,铝离子反应生成偏铝酸钠,充分搅拌、过滤、洗涤得固体.判断为Fe(OH)3,再将所得固体充分加热、灼烧,得红棕色粉末1.60g为Fe2O3,铁的物质的量n(Fe)=$\frac{1.60g}{160g/mol}$×2=0.02mol,n(Al)=$\frac{1.46g-0.07g-0.02mol×56g/mol}{27g/mol}$=0.01mol;
则n(Fe):n(Al):n(Si)=0.02:0.01:0.0025=8:4:1,所以化学式为:Fe8Al4Si,
故答案为:Fe8Al4Si.
点评 本题考查了化学式的确定,题目难度中等,根据题中数据计算出各元素的物质的量再根据物质的量之比等于原子数之比确定化学式,侧重于考查学生的分析能力和计算能力.


科目:高中化学 来源: 题型:选择题
| A. | 7.8 g苯含有碳碳双键的数目为0.3NA | |
| B. | 标准状况下,足量的Fe与2.24 L Cl2反应转移电子的数目为0.3NA | |
| C. | 273K、101kPa下,28 g乙烯与丙烯混合物中含有C-H键的数目为5NA | |
| D. | 100 mL1mol•L-1的NaF中:N(F-)+N(HF)=0.1 NA |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 乙醇(C2H6O)和乙酸(C2H4O2) | B. | 乙醛(C2H4O)和甲醇(CH4O) | ||
| C. | 丙醛(C3H6O)和甘油(C3H8O3) | D. | 丙酮(C3H6O)和丙二醇(C3H8O2) |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 鸡蛋清的水溶液加饱和(NH4)2SO4溶液后,有白色物质析出 | |
| B. | NO2气体经加压变成无色液体 | |
| C. | 溴水滴入植物油中振荡褪色 | |
| D. | 用SO2漂白的草帽日久变黄 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 与新制氢氧化铜反应 | |
| B. | 使溴的四氯化碳溶液褪色 | |
| C. | 与乙醇在浓硫酸催化下发生酯化反应 | |
| D. | 与银氨溶液反应析出银 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | X原子的电子层数比Y原子的电子层数多 | |
| B. | X的氢化物的水溶液酸性比Y的氢化物的水溶液酸性强 | |
| C. | X的气态氢化物比Y的气态氢化物稳定 | |
| D. | Y的单质能将X从NaX的溶液中置换出来 |
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
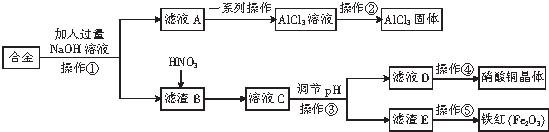
| A. | 滤液A中的溶质主要是NaAlO2和NaOH | |
| B. | 调pH时,可以加入CuO或Cu2(OH)2CO3 | |
| C. | 操作②是在蒸发皿中直接蒸干水分 | |
| D. | 该合金中含有的金属主要为铁、铜、铝 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com