
| A. | 铁与稀硝酸反应:Fe+2H+═Fe2++H2↑ | |
| B. | 氢氧化铁溶液与盐酸反应:OH-+H+═H2O | |
| C. | 锌与硫酸铜溶液反应:Zn+Cu2+═Zn2++Cu | |
| D. | 氢氧化钡溶液与稀硫酸反应:H++SO42-+OH-+Ba2+═BaSO4↓+H2O |
分析 A、铁与稀硝酸反应生成硝酸铁、水以及一氧化氮;
B、氢氧化铁溶液与盐酸反应生成氯化铁和水;
C、锌与硫酸铜溶液反应生成硫酸锌和金属铜;
D、氢氧化钡溶液与稀硫酸反应生成硫酸钡和水.
解答 解:A、铁与稀硝酸反应生成硝酸铁、水以及一氧化氮:Fe+4H++NO3-=Fe3++NO↑+2H2O,故A错误;
B、氢氧化铁溶液与盐酸反应生成氯化铁和水:Fe(OH)3+3H+═Fe3++3H2O,Fe(OH)3不拆,故B错误;
C、锌与硫酸铜溶液反应生成硫酸锌和金属铜,即Zn+Cu2+═Zn2++Cu,故C正确;
D、氢氧化钡溶液与稀硫酸反应生成硫酸钡和水,即2H++SO42-+2OH-+Ba2+═BaSO4↓+2H2O,离子个数符合物质的配比关系,故D错误.
故选C.
点评 本题考查离子反应方程式的正误判断,明确发生的化学反应及离子反应的书写方法即可解答,离子方程式的书写要遵循电荷守恒、原子守恒、转移电子守恒,注意有些化学反应还与反应物的量有关,题目难度不大.


科目:高中化学 来源: 题型:填空题
 碳元素形成的单质具有平面层状结构,同一层中的原子构成许许多多的正六边形,此单质与熔触的钾相互作用,形成某种青铜色的物质(其中的元素钾用“●”表示),原子分布如图所示,该物质的化学式为KC8.
碳元素形成的单质具有平面层状结构,同一层中的原子构成许许多多的正六边形,此单质与熔触的钾相互作用,形成某种青铜色的物质(其中的元素钾用“●”表示),原子分布如图所示,该物质的化学式为KC8.查看答案和解析>>
科目:高中化学 来源: 题型:解答题
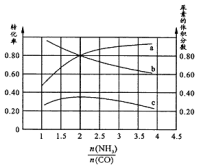 用CO合成尿素的反应为:2NH3(g)+CO(g)?CO(NH2)2(g)+H2(g)△H<0.
用CO合成尿素的反应为:2NH3(g)+CO(g)?CO(NH2)2(g)+H2(g)△H<0.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | N2O | B. | CF2=CF2 | C. | CCl2F2 | D. | SF6 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 加热 | B. | 滴加少量硫酸铜溶液 | ||
| C. | 不用铁片,改用铁粉 | D. | 加少量浓硝酸 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 金属Na着火,立即用水扑灭 | |
| B. | 做蒸馏实验时,应使温度计水银球位于蒸馏烧瓶支管口处 | |
| C. | 衣服沾上大量浓氢氧化钠溶液,需将此衣服浸泡在盛水的盆中 | |
| D. | 测试某溶液的pH时,先用水润湿pH试纸,再将待测液滴到pH试纸上 |
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | ClO-中氯元素显+1价,具有很强的还原性 | |
| B. | 这些离子结合H+的能力,ClO4-最强 | |
| C. | ClO3-是NO3-的等电子体,其空间构型为平面三角形 | |
| D. | ClO2-、ClO3-、ClO4-中的氯原子都采取sp3杂化,离子中相邻两个Cl-O键间键角依次增大 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
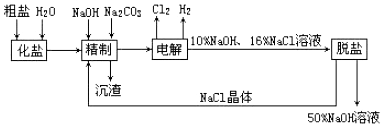
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com