
| A. | 1 L溶液中K+浓度是0.4 mol•L-1 | |
| B. | 溶液中含有0.4NA个K+ | |
| C. | 1 L溶液中所含K+、SO42-总数为0.3NA | |
| D. | 2 L溶液中SO42-浓度是0.4 mol•L-1 |
分析 A.每摩尔硫酸钾含有2mol钾离子,钾离子的浓度为硫酸钾的2倍;
B.根据n=cV计算钾离子的物质的量,再根据N=nNA计算钾离子的数目;
C.根据n=cV计算硫酸钾的物质的量,每摩尔硫酸钾含有3mol离子(2mol钾离子,1mol硫酸根离子),再根据N=nNA计算离子的数目;
D.溶液是均一的,每摩尔硫酸钾含有1mol硫酸根,硫酸根离子的浓度等于硫酸钾的浓度.
解答 解:A.0.2mol/L K2SO4溶液,每摩尔硫酸钾含有2mol钾离子,钾离子的浓度为硫酸钾的2倍,所以K+离子浓度是0.4mol/L,故A正确;
B.溶液体积不知.溶液中含有K+离子数不能计算,故B错误;
C.1L溶液中所含K+、SO42-总数为1L×0.2mol/L×3×NAmol-1=0.6NA,故C错误;
D.溶液是均一的,每摩尔硫酸钾含有1mol硫酸根,硫酸根离子的浓度等于硫酸钾的浓度为0.2mol/L,故D错误.
故选A.
点评 本题考查阿伏加德罗常数,题目难度中等,注意注意溶液是均一的,浓度与体积无关.


科目:高中化学 来源: 题型:选择题
| A. | $\frac{(4b-2c)}{a}$ | B. | $\frac{(2b-c)}{a}$ | C. | $\frac{(4b-4c)}{a}$ | D. | $\frac{(2b-2c)}{a}$ |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 清除可燃物 | B. | 使燃烧物与氧气隔绝 | ||
| C. | 降低燃烧物的着火点 | D. | 使燃烧物的温度降低到着火点以下 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 双氧水加入稀硫酸和KI溶液:H2O2+2H++2I-═I2+2H2O | |
| B. | 在100 mL 2 mol/L FeBr2溶液中通入4.48 L氯气(标况下),充分反应:2Fe2++2Br-+2Cl2═2Fe3++Br2+4Cl- | |
| C. | 向Na2CO3溶液中滴入酚酞溶液,溶液变红:CO32-+H2O?HCO3-+OH- | |
| D. | 向NaHCO3溶液中加入过量的澄清石灰水,出现白色沉淀:2HCO3-+Ca2++2OH-═CaCO3↓+CO32-+2H2O |
查看答案和解析>>
科目:高中化学 来源: 题型:计算题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
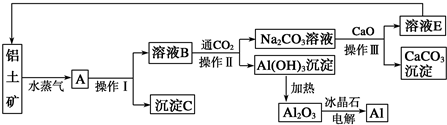
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 发展煤的液化技术被纳入“十二五”规划,中科院山西煤化所有关煤液化技术的高效
发展煤的液化技术被纳入“十二五”规划,中科院山西煤化所有关煤液化技术的高效查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | NaClO | B. | Na2CO3 | C. | KMnO4 | D. | H2O2 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com