
����Ŀ��NaClO2 ��һ����Ҫ��ɱ����������Ҳ������Ư��֯��ȣ�һ������NaClO2 �Ĺ������£�

��֪����ClO2��һ��ǿ���������壬Ũ�ȴ�ʱ�ֽⱬը��������ʹ��ʱҪ��ϡ�����������Ƚ���ϡ�ͣ�ͬʱ������ա��ȡ���NaClO2������Һ���¶ȵ���38��ʱ�����ľ�����NaClO2��33H2O������38��ʱ�����ľ�����NaClO2������60��ʱNaClO2�ֽ��NaClO3��NaCl���ش��������⣺
(1)�����ѧ����������Ӧ������Ļ������о�����H2C2O4����SO2�Ʊ�ClO2���·������÷����Ļ�ѧ����ʽΪ______________________��
(2)��ò�ƷNaClO2�����������������²��裺
����ѹ��55�������ᾧ�������ȹ��ˣ���___________________________������60������õ���Ʒ��
(3)Ϊ�˲ⶨ��ƷNaClO2�Ĵ��ȣ�ȡ�������ò�Ʒ12.5g����ˮ���1L��Һ��ȡ��10.00mL��Һ����ƿ�У��ټ��������ữ��KI��Һ����ַ�Ӧ��(ClO2������ԭΪCl�����ʲ��μӷ�Ӧ)������2~3�ε�����Һ����0.25molL��1Na2S2O3��Һ�ζ����ﵽ�ζ��յ�ʱ��ȥ��Һ20.00mL���Լ����ƷNaClO2�Ĵ���_________________________(��ʾ��2Na2S2O3+I2=Na2S4O6+2NaI)
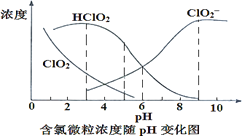
(4)NaClO2��Һ�д���ClO2��HClO2��ClO2����Cl�����ֺ����������ⶨ 25����������Ũ���� pH �ı仯�����ͼ��ʾ(Cl��û�л���)
������������NaClO2��Һ�д���Cl����ԭ����_______________________(�����ӷ���ʽ����)��
��pH=5ʱ��NaClO2��Һ��ClO2��HClO2��ClO2����Cl�����ֺ�������Ũ���ɴ�С��˳����___________________________________________________��
���𰸡�2NaClO3+H2C2O4+H2SO4=Na2SO4+2H2O+2CO2��+2ClO2�� ��38��~60�����ˮϴ�� 90.5% 5ClO2-+4H+![]() 4ClO2+Cl-+2H2O c(HClO2)>c(ClO2��)>c(ClO2)>c(Cl��)
4ClO2+Cl-+2H2O c(HClO2)>c(ClO2��)>c(ClO2)>c(Cl��)
��������
���Ʊ����̿�֪��NaClO3��SO2�������ữ�������·�Ӧ����ClO2������NaClO3�������������ղ���ΪNaHSO4��˵�������������ƣ�������ClO2�����ݵ���غ�ɵ÷�Ӧ�ķ���ʽΪ2NaClO3+SO2+H2SO4=2NaHSO4+2ClO2��ѡ��NaOH��ȥʳ��ˮ�е�Mg2+ѡ��̼���Ƴ�ȥCa2+�����װ��������ClO2�õ�������ClO2-������Cl-ʧ��������Cl2����H2O2��NaOH��Һ����ClO2������ΪClO2-�����NaClO2��Һ�ᾧ������õ���Ʒ���Դ˷�������
��1���������ữ�IJ�����Һ��ԭ�����ƣ���Ӧ���������ơ�CO2��ClO2��ˮ����Ӧ����ʽΪ��2NaClO3+H2C2O4+H2SO4=Na2SO4+2H2O+2CO2��+2ClO2����
��2����ò�ƷNaClO2���������Ϣ��֪Ӧ��38��~60�����ˮϴ�ӣ�
��3��NaClO2�������ữ��KI��Һ��Ӧ������ʽΪ��ClO2-+4I-+4H+=2H2O+2I2+Cl-������ݹ�ϵNaClO2~2I2~4S2O32-��֪NaClO2�����ʵ���Ϊ![]() =1.25��10-3mol��10ml��Ʒ��m(NaClO2)= 1.25��10-3mol��90.5g/mol�����ԭ��Ʒ��NaClO2����������Ϊ
=1.25��10-3mol��10ml��Ʒ��m(NaClO2)= 1.25��10-3mol��90.5g/mol�����ԭ��Ʒ��NaClO2����������Ϊ ��100%=90.5%��
��100%=90.5%��
��4����������Һ��NaClO2����������Ӧ����NaCl��ClO2�����ӷ���ʽΪ��5ClO2-+4H+![]() 4 ClO2+Cl-+2H2O��
4 ClO2+Cl-+2H2O��
����ͼ���֪��pH=5ʱ�������ķ�ӦΪ��5ClO2-+4H+![]() 4 ClO2+Cl-+2H2O��NaClO2��Һ�к���Ԫ�ص���Ũ�ȵĴ�С��ϵΪ��c(HClO2)>c(ClO2��)>c(ClO2)>c(Cl��)
4 ClO2+Cl-+2H2O��NaClO2��Һ�к���Ԫ�ص���Ũ�ȵĴ�С��ϵΪ��c(HClO2)>c(ClO2��)>c(ClO2)>c(Cl��)


 �����Ծ���Ԫ���Ծ�ϵ�д�
�����Ծ���Ԫ���Ծ�ϵ�д�
| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��ij�¶�����2L�ܱ������м���һ����A���������»�ѧ��Ӧ��
2A(g)![]() B(g)+C(g)����H =��48.25 kJ��mol��1����Ӧ������B��A��Ũ�ȱ���ʱ��t����ͼ��ʾ��ϵ������õ�15minʱc(B)=1.6 mol��L��1�����н�����ȷ����
B(g)+C(g)����H =��48.25 kJ��mol��1����Ӧ������B��A��Ũ�ȱ���ʱ��t����ͼ��ʾ��ϵ������õ�15minʱc(B)=1.6 mol��L��1�����н�����ȷ����

A.���¶��´˷�Ӧ��ƽ�ⳣ��Ϊ3.2
B.A�ij�ʼ���ʵ���Ϊ4 mol
C.��Ӧ����ƽ��ʱ���ų���������193kJ
D.��Ӧ��ƽ��ʱ��A��ת����Ϊ80%
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��һ�������£������Ϊ10L���ܱ������У�2molX��2molY�������·�Ӧ��2X(g)+Y(g)Z(g)����2min�ﵽƽ�⣬����0.6molZ������˵����ȷ���ǣ� ��
A.��XŨ�ȱ仯��ʾ�ķ�Ӧ����Ϊ0.06mol/(Lmin)
B.�����������Ϊ20L��Z��ƽ��Ũ��Ϊԭ����![]()
C.ƽ��ʱ��X��ת����Ϊ30%
D.��ʼ״̬��ƽ��ʱ�����ڵ�����ѹǿ��Ϊ2��1
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��ij�о���ѧϰС���ͬѧΪ��ʵ�������ֶ�������������Ĺ��̣�����ȡ�������������壬�������ͼ��ʾ��װ�á���֪����������ˮ�������Ტ�ų������ȣ������γ��������Իش�

��1����֪450��ʱ����Ӧ2SO2(g)��O2(g)![]() 2SO3(g)��ƽ�ⳣ��K��25������450��ʱ��2SO3(g)
2SO3(g)��ƽ�ⳣ��K��25������450��ʱ��2SO3(g)![]() 2SO2(g)��O2(g)�Ļ�ѧƽ�ⳣ��Ϊ___��
2SO2(g)��O2(g)�Ļ�ѧƽ�ⳣ��Ϊ___��
��2��A�е��Լ���___��
��3����ʵ������в��س������ȣ�˵����ƽ��ġ�H___0������>��������������<����,Cװ�������ռ������������б���ˮ��������___������32gͭ������Ũ���ᷴӦ��ȡ��������ʵ�����ʱ�õ�20g��������ʵ���ж��������ת���ʲ�С��___��
��4����ָ������ʵ��װ�õ�����ȱ���ǣ�___��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ������ͼ��ʾ��ͼ���Ǻ�ѹ�ܱ�������ͼ���Ǻ����ܱ�������������������ͬʱ�����������зֱ����2mol![]() ��2mol
��2mol![]() ����ʼʱ�����������ΪVL���������·�Ӧ���ﵽƽ��״̬
����ʼʱ�����������ΪVL���������·�Ӧ���ﵽƽ��״̬![]() ��ʾ������X��Y��״̬��δ֪������Z��״̬Ϊ��̬)��2X(?)+Y(?)
��ʾ������X��Y��״̬��δ֪������Z��״̬Ϊ��̬)��2X(?)+Y(?)![]() aZ(g)��ʱ����X��Y��Z�����ʵ���֮��Ϊ1:3:2�������ж���ȷ����
aZ(g)��ʱ����X��Y��Z�����ʵ���֮��Ϊ1:3:2�������ж���ȷ����![]()
![]()
�� ��
�� ��
��
A.����Z�Ļ�ѧ������ a= 2
B.��X��Y��Ϊ��̬������ƽ��ʱX��ת���ʣ���<��
C.������������ܶ���ͼ����ʾ����X��Y��ֻ��һ��Ϊ��̬
D.��XΪ��̬��YΪ��̬�����������дӿ�ʼ��ƽ�������ʱ�䣺��>��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ���ݱ�������300����70MPa���ɶ�����̼�������ϳ��Ҵ��ѳ�Ϊ��ʵ��2CO2��g��+6H2��g��![]() CH3CH2OH��g��+3H2O��g�������������������
CH3CH2OH��g��+3H2O��g�������������������
A.ʹ��Cu-Zn-Fe�����ɴ���������Ч��
B.��Ӧ����300�����п��Ʋ�÷�Ӧ�����ȷ�Ӧ
C.�������CO2��������H2��ת����
D.��ƽ���������з����CH3CH2OH��H2O�����CO2��H2��������
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��Ϊ��ʵ����Դ�������ij���������ϳɰ����ƴ������������![]() �������ϣ������������£�
�������ϣ������������£�
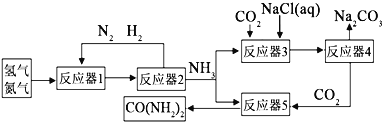
![]() ʱ101kPaʱ���������17g
ʱ101kPaʱ���������17g![]() ���ų�
���ų�![]() ������д���ϳ�
������д���ϳ�![]() ���Ȼ�ѧ����ʽ ______ ��
���Ȼ�ѧ����ʽ ______ ��
![]() �ϳɰ�ԭ�����е�����������ϡ��ˮ���գ�����Ʒ����ʽ�Σ��ø���Ʒ�Ļ�ѧʽΪ ______ ��
�ϳɰ�ԭ�����е�����������ϡ��ˮ���գ�����Ʒ����ʽ�Σ��ø���Ʒ�Ļ�ѧʽΪ ______ ��
![]() ��Ӧ��2��������ĵ�����������ͨ�뷴Ӧ��1����Ŀ���� ______
��Ӧ��2��������ĵ�����������ͨ�뷴Ӧ��1����Ŀ���� ______ ![]() ��Ӧ��3����ԭ�ϵ�˳���ǣ��ȼ��Ȼ�����Һ��ͨ�백�������ͣ���ͨ�������Ķ�����̼���Ƶ�
��Ӧ��3����ԭ�ϵ�˳���ǣ��ȼ��Ȼ�����Һ��ͨ�백�������ͣ���ͨ�������Ķ�����̼���Ƶ�![]() ��Ӧ��3�еĻ�ѧ����ʽΪ ______ ��
��Ӧ��3�еĻ�ѧ����ʽΪ ______ ��
![]() ��ҵ�Ͽ���̼��������ˮ������Ӧ������
��ҵ�Ͽ���̼��������ˮ������Ӧ������
![]() ��
��![]() ���˷�Ӧ�Ļ�ѧƽ�ⳣ������ʽΪ
���˷�Ӧ�Ļ�ѧƽ�ⳣ������ʽΪ![]() ______ ��Ϊ�����̼��ת���ʣ��˲������д�ʩ�е�
______ ��Ϊ�����̼��ת���ʣ��˲������д�ʩ�е�![]() ����ĸ���
����ĸ���![]() ______ ��
______ ��
A.����ѹǿ![]() ����̼����
����̼����![]() �����¶�
�����¶�![]() ����ˮ����
����ˮ����![]() ʹ�ô���
ʹ�ô���![]() ��ʱ�Ƴ�CO��
��ʱ�Ƴ�CO��![]()
![]() ��Щ����ˮ��ḻ�����ö��Ե缫�����������Һ�����������ʱ�����ϵĵ缫��ӦʽΪ ______ ��
��Щ����ˮ��ḻ�����ö��Ե缫�����������Һ�����������ʱ�����ϵĵ缫��ӦʽΪ ______ ��
![]() ������
������![]() ��������
��������![]() Ϊԭ��������
Ϊԭ�������� ����״����
����״����![]()
![]() ��������������� ______
��������������� ______ ![]() ���أ�
���أ�
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��ˮú����CO��H2���Ǻϳɼ״�����Ҫԭ�ϣ�������ˮ����ͨ�����ȵ�̿���Ƶã�C��s��+H2O��g��![]() CO��g��+H2��g�� ��H=+131.3 kJ��mol-1
CO��g��+H2��g�� ��H=+131.3 kJ��mol-1
��1���÷�Ӧ��ƽ�ⳣ���ı���ʽΪ_________________�������¶ȣ�Kֵ��________�������������ƽ����Է���������________�������������С�����䡱����
��2��������Ӧ�ﵽƽ�����ϵ�е�C��s���������ߣ�ƽ�⽫________������ĸ����
A.������ B.������ C.���ƶ�
��3��������ʵ��˵���÷�Ӧ��һ���������Ѵﵽƽ��״̬����________������ĸ����
A.��λ�����ÿ����1 mol CO��ͬʱ����1 mol H2
B.������������ʵ������ֲ���
C.����H2O��g��������������CO���������
D.H2O��g����CO��H2��Ũ�����
��4��ij�¶��£���4.0 mol H2O��g����������̿����2 L���ܱ������У��������·�Ӧ��C��s��+H2O��g��![]() CO��g��+H2��g�����ﵽƽ��ʱ���K=1������¶���H2O��g����ת����Ϊ________��
CO��g��+H2��g�����ﵽƽ��ʱ���K=1������¶���H2O��g����ת����Ϊ________��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ������˵���������ˮ���йص���![]()
��������![]() ������ˮ����
������ˮ����
��ʵ����ʢ��![]() ��
��![]() ����Һ���Լ�ƿӦ����Ƥ�����������ò�������
����Һ���Լ�ƿӦ����Ƥ�����������ò�������
�۳���ʩ������泥�����������ǿ��
��![]() ��
��![]() ��Һ���������еij������
��Һ���������еij������
����ľ�����̬���ʲ��ܻ��ʩ�ã�
����![]() ��
��![]() ������Һ������ĭ������
������Һ������ĭ������
A.�٢�B.����C.����D.ȫ��
�鿴�𰸺ͽ���>>
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com