
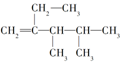
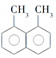
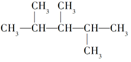

| A. | ①和② | B. | ②和③ | C. | ①和③ | D. | ②和④ |
科目:高中化学 来源: 题型:选择题
| A. | 标准状况下,2.24 LCCl4含有的共价键数为0.4NA | |
| B. | 1 molN2与4 mol H2反应生成的NH3分子数为2NA | |
| C. | 1 molFe溶于过量硝酸,电子转移数为2NA | |
| D. | 34g H2O2和H2S混合物中的氢原子数为2NA |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 采取低碳、节俭的生活方式 | B. | 按规定对生活废弃物进行分类放置 | ||
| C. | 经常使用一次性筷子、塑料袋 | D. | 深入农村和社区,加强环保宣传 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 未加NaOH溶液时,c(H+)>c(CI-)═c(CH3COOH) | |
| B. | 加入10mLNaOH溶液时:c(CH3COO-)+c(OH-)═c(H+) | |
| C. | 加入NaOH溶液至PH=7时:c(Na+)═c(CI-) | |
| D. | 加入20mLNaOH溶液时:c(Na+)═c(CH3COO-)+c(CI-) |
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
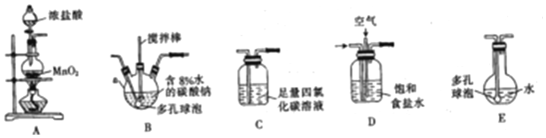
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
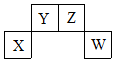 短周期元素X、Y、Z、W在周期表中的位置关系如图,X元素的单质既能与强酸溶液反应,又能与强碱溶液反应.下列说法正确的是( )
短周期元素X、Y、Z、W在周期表中的位置关系如图,X元素的单质既能与强酸溶液反应,又能与强碱溶液反应.下列说法正确的是( )| A. | X的单质投入冷浓硫酸中剧烈反应 | |
| B. | 几种最低价气态氢化物稳定性:Z>W | |
| C. | W的氧化物对应的水化物一定是强酸 | |
| D. | Z的氧化物对环境有污染,Y的氧化物没有污染 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
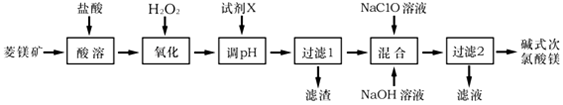
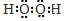 ,它的作用是将Fe2+氧化为Fe3+.
,它的作用是将Fe2+氧化为Fe3+.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 含有共价键的化合物一定是共价化合物 | |
| B. | Na2O2中既含有离子键又含有非极性共价键 | |
| C. | KOH中只含有共价键 | |
| D. | KI和HI中化学键类型完全相同 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com