
| 实验 编号 | 温度 (℃) | 催化剂 用量(g) | 酸性高锰酸钾溶液 | |
| 体积(mL) | 浓度(mol/L) | |||
| 1 | 25 | 0.5 | 4.00 | 0.1000 |
| 2 | 50 | 0.5 | 4.00 | 0.1000 |
| 3 | 25 | 0.5 | 4.00 | 0.0100 |
| 4 | 25 | 0 | 4.00 | 0.1000 |
| 实验 编号 | 溶液褪色所需时间(min) | ||
| 第 1 次 | 第 2 次 | 第 3 次 | |
| 1 | 14.0 | 13.0 | 11.0 |
| 2 | 6.5 | 6.7 | 6.8 |
分析 (1)高锰酸钾具有强氧化性,能把草酸氧化成二氧化碳,自身被还原成二价锰离子;
(2)A.15.8gKMnO4物质的量为0.1mol,溶于1L水中所得溶液的体积大于1L;
B.固体应先在烧杯中溶解,然后转移入容量瓶;
C.需要90mL的溶液,因为没有90mL容量瓶,故需要100mL容量瓶,经计算得知:配制0.1mol/L的KMnO4溶液,应准确称量固体1.58g;
D.定容时仰视容量瓶颈刻度线读数,会使配制的溶液浓度偏低;
(3)Ⅱ实验1、2反应物用量完全相同,只有温度不同,目的就在于探究温度不同对反应速率的影响;
(4)高锰酸钾的物质的量相同,浓度不同的草酸溶液,可以探究反应物浓度对该反应速率的影响;
(5)酸性条件下,高锰酸根离子能将氯离子氧化成氯气;
(6)由工艺流程转化关系可知,MnO2、KOH的熔融混合物中通入空气时发生反应生成K2MnO4,根据元素守恒还应生成水.反应中锰元素由+4价升高为+6价,总升高2价,氧元素由0价降低为-2价,总共降低4价,化合价升降最小公倍数为4,所以MnO2系数2,O2系数为1,根据锰元素守恒确定K2MnO4系数,根据钾元素守恒确定KOH系数,根据氢元素守恒确定H2O系数;
(7)由工艺流程转化关系可知,向K2MnO4溶液中通入CO2制备KMnO4、还生成K2CO3、MnO2,故化学方程式为3K2MnO4+2CO2=2KMnO4+2K2CO3+MnO2,升失氧化还原剂,得到的是氧化产物,降得还原氧化剂得到的是还原产物,据此进行分析.
解答 解:(1)高锰酸钾具有强氧化性,把草酸中的C从+3价氧化成+4价的二氧化碳,Mn元素从+7价变化到+2价的锰离子,由于草酸分子中有2个C原子,所以高锰酸钾与草酸的反应比例为 5:2,故反应的方程式为:2MnO4-+5H2C2O4+6H+=2Mn2++10CO2↑+8H2O,
故答案为:2MnO4-+5H2C2O4+6H+=2Mn2++10CO2↑+8H2O;
(2)A.15.8gKMnO4物质的量为0.1mol,溶于1L水中所得溶液的体积大于1L,故A错误;
B.固体应先在烧杯中溶解,然后转移入容量瓶,不能在容量瓶中溶解,故B错误;
C.需要90mL的溶液,因为没有90mL容量瓶,故需要100mL容量瓶,经计算得知:配制0.1mol/L的KMnO4溶液,应准确称量固体1.58g,故C正确;
D.定容时仰视容量瓶颈刻度线读数,会使配制的溶液浓度偏低,故D错误,
故答案为:C;
(3)Ⅱ实验1、2反应物用量完全相同,只有温度不同,目的就在于探究温度不同对反应速率的影响;
故答案为:探究温度不同对反应速率的影响;
(4)因根据表格中的褪色时间长短来判断浓度大小与反应速率的关系,需满足高锰酸钾的物质的量相同,浓度不同的草酸溶液,故甲同学改进的实验方案其它条件相同时,利用等量且少量的高锰酸钾与等体积不同浓度的足量草酸溶液反应,测量溶液褪色时间,
故答案为:其它条件相同时,利用等量且少量的高锰酸钾与等体积不同浓度的足量草酸溶液反应,测量溶液褪色时间;
(5)酸性条件下,高锰酸根离子能将氯离子氧化成氯气,自身被还原成二价锰离子,反应方程式为2MnO4-+10Cl-+16H+=5Cl2↑+2Mn2++8H2O,
故答案为:2MnO4-+10Cl-+16H+=5Cl2↑+2Mn2++8H2O.
(6)由工艺流程转化关系可知,MnO2、KOH的熔融混合物中通入空气时发生反应生成K2MnO4,根据元素守恒还应生成水.反应中锰元素由+4价升高为+6价,总升高2价,氧元素由0价降低为-2价,总共降低4价,化合价升降最小公倍数为4,所以MnO2系数2,O2系数为1,根据锰元素守恒确定K2MnO4系数为2,根据钾元素守恒确定KOH系数为4,根据氢元素守恒确定H2O系数为2,所以反应化学方程式为2MnO2+4KOH+O2$\frac{\underline{\;高温\;}}{\;}$2K2MnO4+2H2O,
故答案为:2MnO2+4KOH+O2$\frac{\underline{\;高温\;}}{\;}$2K2MnO4+2H2O;
(7)由工艺流程转化关系可知,向K2MnO4溶液中通入CO2制备KMnO4、还生成K2CO3、MnO2,故化学方程式为3K2MnO4+2CO2=2KMnO4+2K2CO3+MnO2,升失氧化还原剂,得到的是氧化产物,故氧化产物为KMnO4,降得还原氧化剂得到的是还原产物,故还原产物为MnO2,故氧化产物与还原产物的物质的量之比为2:1,
故答案为:2:1.
点评 本题考查了探究温度、浓度对反应速率的影响、浓度随时间变化的曲线,题目难度中等,试题侧重对学生能力的培养和解题方法的指导与训练,旨在考查学生灵活运用基础知识解决实际问题的能力.


 优等生题库系列答案
优等生题库系列答案 53天天练系列答案
53天天练系列答案科目:高中化学 来源:2016-2017学年河南省新乡市高二上第一次月考化学卷(解析版) 题型:选择题
根据下表的数据,H2(g)+Cl2(g)==2HCl(g)的反应热应为( )
部分物质的键能
H2 | Cl2 | HCl | |
键能(kJ·mol-1) | 436 | 243 | 431 |
A.+183.0 kJ·mol-1 B.-366.0 kJ·mol-1
C.-183.0 kJ·mol-1 D.+211.0 kJ·mol-1
查看答案和解析>>
科目:高中化学 来源:2016-2017学年重庆市高二上第一次月考化学卷(解析版) 题型:选择题
现有两正盐的稀溶液,分别是a mol/L NaX溶液和b mol/L NaY溶液。下列说法不正确的是
A.若a>b,测得c(X-)=c(Y-),可推出溶液中的c(HX)>c(HY)
B.若a>b,测得c(X-)=c(Y-),可推出溶液中的c(HX)=c(HY)
C.若a=b,且pH(NaX)>pH(NaY),则浓度相同时,酸性HX<HY
D.若a=b,并测得 a=c(X-)=c(Y-)+c(HY),则HX是强酸,HY是弱酸
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
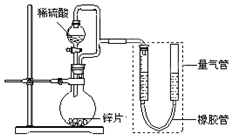 某同学设计了如图所示装置(部分夹持装置已略去),该装置可以用来进行多项实验研究.
某同学设计了如图所示装置(部分夹持装置已略去),该装置可以用来进行多项实验研究.| 序号 | V(H2SO4)/mL | c(H2SO4)/mol•L-1 | t/s |
| Ⅰ | 40 | 1 | t1 |
| Ⅱ | 40 | 4 | t2 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 1mol金属钠含有的电子数 | |
| B. | 标准状况下,22.4L酒精所含的分子数 | |
| C. | 12g12C所含的原子数 | |
| D. | 1L 1mol/L的硫酸溶液中所含的H+ |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 研究含氮、硫污染物的治理是环保的一项重要工作.
研究含氮、硫污染物的治理是环保的一项重要工作.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 18g2H2O中含有的电子数目为NA | |
| B. | 0.1L0.5mol/LCH3COOH溶液中含有的氢离+数为0.05NA | |
| C. | 常温常压,22.4LC12中含有的分子数为6.02×1023个 | |
| D. | 常温常压下,足量的金属Al与lmolCl2共热,转移电子数为2NA |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 1molCl2与Fe粉完全反应时转移电子数为2NA | |
| B. | 过氧化钠与水反应时,每生成1molO2,转移4mol电子 | |
| C. | 标准状况下,11.2L氟化氢中含有氟原子的数目为0.5NA | |
| D. | 0.1 mol•L-1NaHSO4溶液中,阳离子数目之和为0.3NA |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 苯酚钠溶液中通入CO2: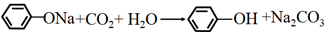 | |
| B. | 常温下CH2=CHCH3与水接触:CH2=CHCH3+H2O→CH3CH(OH)CH3 | |
| C. | 乙醇和金属钠发生反应放出氢气:2CH3CH2OH+2 Na→2CH3CH2ONa+H2↑ | |
| D. | 甲苯与氯气在铁粉催化作用下发生反应: |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com