
| A. | ①④ | B. | ③⑤ | C. | ②③④⑤ | D. | ①②③④ |
分析 ①蒸馏时测量馏分温度;
②溴和乙烯、SO2都反应;
③用乙醇与浓硫酸H2SO4混合共热到170℃制取乙烯;
④将苯和液溴混合后加入Fe粉制溴苯;
⑤将饱和食盐水滴入盛有电石的烧瓶中制乙炔,用食盐水代替水能减缓反应速率.
解答 解:①蒸馏时测量馏分温度,温度计水银球应该位于蒸馏烧瓶支管口处,故错误;
②溴能和乙烯发生加成反应、能和二氧化硫发生氧化还原反应,所以溴和乙烯、SO2都反应,故错误;
③用乙醇与浓硫酸H2SO4混合共热到170℃制取乙烯,浓硫酸作催化剂和脱水剂,不能用稀硫酸,故错误;
④将苯和液溴混合后加入Fe粉制溴苯,苯和溴水不反应,但能萃取溴水中的溴,故错误;
⑤电石和水反应生成氢氧化钙和乙炔,为防止反应速率过快,将饱和食盐水滴入盛有电石的烧瓶中制乙炔,故正确;
故选D.
点评 本题考查化学实验方案评价,涉及反应速率影响因素、物质的制备、物质的分离和提纯等知识点,明确实验原理是解本题关键,从实验操作规范性及物质的性质进行评价,题目难度不大.


 第1卷单元月考期中期末系列答案
第1卷单元月考期中期末系列答案科目:高中化学 来源: 题型:选择题
| A. | K+、NH4+、NO3-、Cl- | B. | Na+、K+、NH4+、Cl- | ||
| C. | NH4+、K+、HCO3-、Cl- | D. | Na+、Cu2+、Br-、Cl- |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 原子的最外层电子排布不一定都是以p6结束 | |
| B. | 化学性质非常不活泼 | |
| C. | 其原子与同周期ⅠA、ⅡA族阳离子具有相同电子排布式 | |
| D. | 原子半径比同周期ⅦA族元素原子的大 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
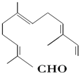 现有试剂:
现有试剂:| A. | ①② | B. | ②③ | C. | ③④ | D. | ①④ |
查看答案和解析>>
科目:高中化学 来源: 题型:多选题
| 元素代号 | L | M | Q | R | T |
| 原子半径/nm | 0.160 | 0.143 | 0.089 | 0.102 | 0.074 |
| 主要化合价 | +2 | +3 | +2 | +6、-2 | -2 |
| A. | L2+与R2-的核外电子数相等 | |
| B. | M与T形成的化合物既能与强酸反应又能与强碱反应 | |
| C. | 氢化物的沸点为H2T>H2R | |
| D. | 单质与浓度相等的稀盐酸反应的剧烈程度为Q>L |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 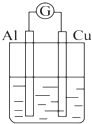 NaOH溶液 | B. | 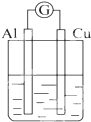 稀硫酸 | C. | 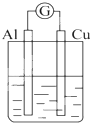 稀硝酸 | D. |  稀盐酸 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| 主族 周期 | ⅠA | ⅡA | ⅢA | ⅣA | ⅤA | ⅥA | ⅦA | 0族 |
| 2 | ① | ② | ③ | |||||
| 3 | ④ | ⑤ | ⑥ | ⑦ | ⑧ | |||
| 4 | ⑨ |
 ,该化合物属于离子(填“共价”或“离子”)化合物.
,该化合物属于离子(填“共价”或“离子”)化合物. ,该化合物是由极性(填“极性”“非极性”下同)键形成的.
,该化合物是由极性(填“极性”“非极性”下同)键形成的.查看答案和解析>>
科目:高中化学 来源: 题型:多选题
| A. | 2 C6H5ONa+H2O+CO2→2 C6H5OH+Na2CO3 | |
| B. | C6H5ONa+H2O+CO2→C6H5OH+NaHCO3 | |
| C. | C6H5OH+Na2CO3→C6H5ONa+NaHCO3 | |
| D. | C6H5OH+NaHCO3→C6H5ONa+H2CO3 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com