
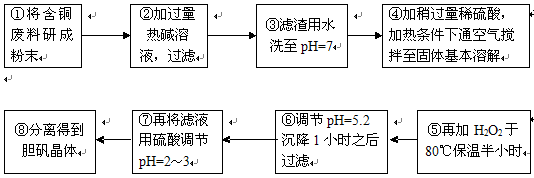
(16分)工业上需要利用一批回收的含铜废料制造胆矾(CuSO4·5H2O)。该废料中各种成份含量如下:Cu和CuO约占87%,其它为Mg、Al、Fe、Si及其氧化物,还有少量的难溶物质。工艺流程为:

部分金属阳离子以氢氧化物形式完全沉淀时溶液的pH如下表:
|
沉淀物 |
Al(OH)3 |
Fe(OH)3 |
Cu(OH)2 |
Mg(OH)2 |
Fe(OH)2 |
|
pH |
5.2 |
3.1 |
6.7 |
9.4 |
9.7 |
回答:
(1)步骤①中为什么要将含铜废料研磨成粉状?
。
(2)步骤②中的离子方程式(写出2个即可):
、 。
步骤⑤中H2O2参加反应的离子方程式: 。
(3)步骤⑥中调节溶液pH时适宜的物质是 (填序号);
A.NaOH B.氨水 C.Cu2(OH)2CO3 D.Cu(OH)2 E.MgCO3
步骤⑥中滤渣成份的化学式 。
(4)步骤⑦中用硫酸调节pH=2~3的原因是 。
步骤⑧的分离方法是 。
(16分)(1)增大固体反应物的表面积,增大化学反应的速率。(2分)
(2)2Al+2OH-+2H2O=2AlO2-+3H2↑; Si+2NaOH+H2O=Na2SiO3+2H2↑;
Al2O3+2OH-=2AlO2-+H2O; SiO2+2NaOH=Na2SiO3+H2O 。
(每写出其中1个给2分,共4分,没气体符号扣1分,未配平0分)
2Fe2+ +H2O2 +2H+ =2Fe3+ +2H2O (2分)
(3)C、D (2分) Fe(OH)3 (1分)
(4)加热蒸发浓缩时会导致Cu2+发生水解生成Cu(OH)2,用硫酸调节pH=2~3是为了抑制Cu2+的水解,也不会引入杂质。 (2分) 蒸发浓缩,冷却结晶,过滤。 (3分)
【解析】(1)将含铜废料研磨成粉状,可以)增大固体反应物的表面积,增大化学反应的速率。
(2)废料中能和氢氧化钠反应的是铝、硅、氧化铝和二氧化硅,所以方程式为2Al+2OH-+2H2O=2AlO2-+3H2↑、Si+2NaOH+H2O=Na2SiO3+2H2↑、Al2O3+2OH-=2AlO2-+H2O、SiO2+2NaOH=Na2SiO3+H2O。双氧水的目的是氧化混合液中的亚铁离子,生成铁离子,以形成氢氧化铁沉淀而除去,所以方程式为2Fe2+ +H2O2 +2H+ =2Fe3+ +2H2O。
(3)用于既要调节溶液的pH,又不能引入杂质,所以应该选择CD。通过控制溶液的pH以形成氢氧化铁沉淀,即步骤⑥中滤渣成份的化学式Fe(OH)3 。
(4)由于溶液中铜离子水解显酸性,加热蒸发浓缩时会导致Cu2+发生水解生成Cu(OH)2,所以用硫酸调节pH=2~3是为了抑制Cu2+的水解,且也不会引入杂质。要从溶液中分离得到硫酸铜晶体,可以通过蒸发浓缩,冷却结晶,过滤即可。


 备战中考寒假系列答案
备战中考寒假系列答案科目:高中化学 来源: 题型:
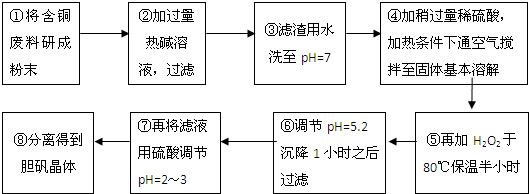
| 沉淀物 | Al(OH)3 | Fe(OH)3 | Cu(OH)2 | Mg(OH)2 | Fe(OH)2 |
| pH | 5.2 | 3.1 | 6.7 | 9.4 | 9.7 |
查看答案和解析>>
科目:高中化学 来源:2012届福建省厦门市翔安一中高三12月月考化学试卷 题型:填空题
(12分)工业上需要利用一批回收的含铜废料制造胆矾(CuSO4·5H2O)。该废料中各种成份含量如下:Cu和CuO约占87%,其它为Al、Fe、Si及其氧化物,还有少量的难溶物质。工艺流程为:
部分金属阳离子以氢氧化物形式完全沉淀时溶液的pH如下表:
| 沉淀物 | Al(OH)3 | Fe(OH)3 | Cu(OH)2 | Mg(OH)2 | Fe(OH)2 |
| pH | 5.2 | 3.1 | 6.7 | 9.4 | 9.7 |
 。
。 。
。查看答案和解析>>
科目:高中化学 来源:2012届广东省连州市连州中学高三12月月考理科综合化学试卷(带解析) 题型:问答题
(16分)工业上需要利用一批回收的含铜废料制造胆矾(CuSO4·5H2O)。该废料中各种成份含量如下:Cu和CuO约占87%,其它为Mg、Al、Fe、Si及其氧化物,还有少量的难溶物质。工艺流程为: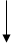
部分金属阳离子以氢氧化物形式完全沉淀时溶液的pH如下表:
| 沉淀物 | Al(OH)3 | Fe(OH)3 | Cu(OH)2 | Mg(OH)2 | Fe(OH)2 |
| pH | 5.2 | 3.1 | 6.7 | 9.4 | 9.7 |
查看答案和解析>>
科目:高中化学 来源:2013-2014学年江苏省苏北四市高三上期末统考化学试卷(解析版) 题型:填空题
高纯超微细草酸亚铁可用于合成新型锂电池电极材料,工业上可利用提取钛白粉的副产品绿矾(FeSO4·7H2O)通过下列反应制备:
FeSO4+2NH3·H2O=Fe(OH)2↓+(NH4)2SO4
Fe(OH)2+H2C2O4=FeC2O4+2H2O
(1)绿矾中含有一定量的TiOSO4杂质。将绿矾溶于稀硫酸,加入铁粉、搅拌、充分反应并保持一段时间,过滤,可得纯净的FeSO4溶液。在上述过程中,TiOSO4能与水反应转化为H2TiO3沉淀,写出该反应的化学方程式: ;加入铁粉的作用有 、 。
(2)由纯净的FeSO4溶液制取FeC2O4时,需在真空环境下进行,原因是 。
FeC2O4生成后,为提高产品纯度,还需调节溶液pH=2,若pH过低,则导致
FeC2O4的产率 (填“偏高”、“偏低”或“无影响”)。
(3)将含有FeC2O4的混合液过滤,将产品先用水洗涤,再用无水乙醇清洗。无水乙醇的作用是 、 。
(4)某研究小组欲从某化工残渣(主要成分为Fe2O3、SiO2、Al2O3)出发,先制备较纯净的FeSO4溶液,再合成FeC2O4。请补充完整由该化工残渣制备较纯净的FeSO4溶液的实验步骤(可选用的试剂:铁粉、稀硫酸和NaOH溶液):向一定量该化工残渣中加入足量的稀硫酸充分反应,过滤, ,过滤,得到较纯净的FeSO4溶液。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com