
| 实验编号 | NaOH溶液的浓度 (mol/L) | 滴定完成时,消耗NaOH溶液的体积(mL) | 待测盐酸溶液的体积(mL) |
| 1 | 0.10 | 20.02 | 20.00 |
| 2 | 0.10 | 20.00 | 20.00 |
| 3 | 0.10 | 19.98 | 20.00 |
分析 (1)结合m=cVM计算;在烧杯中溶解、冷却后转移到容量瓶中定容;
(2)量取20.00mL的稀盐酸,选择酸式滴定管,NaOH滴定盐酸,选择酚酞为指示剂,开始为无色,滴定终点为红色;
(3)由数据可知,消耗NaOH的体积为$\frac{20.02mL+20.00mL+19.98mL}{3}$=20.00mL,结合n(HCl)=n(NaOH)计算.
(4)由c(盐酸)=$\frac{c(NaOH)V(NaOH)}{V(盐酸)}$可知,不当操作使V(NaOH)偏大,则会造成测定结果偏高.
解答 解:(1)步骤一需要称量氢氧化钠固体的质量为0.25L×0.1mol/L×40g/mol=1.0g;在烧杯中溶解、冷却后转移到容量瓶中定容,还需要仪器为250mL容量瓶,胶头滴管,故答案为:1.0;250mL容量瓶,胶头滴管;
(2)步骤二中量取20.00mL的稀盐酸用到的仪器是酸式滴定管.判断滴定终点的现象是最后一滴NaOH溶液加入时,溶液颜色恰好由无色变为(浅)红色,且半分钟内不褪色,
故答案为:酸式滴定管;最后一滴NaOH溶液加入时,溶液颜色恰好由无色变为(浅)红色,且半分钟内不褪色;
(3)由数据可知,消耗NaOH的体积为$\frac{20.02mL+20.00mL+19.98mL}{3}$=20.00mL,c(盐酸)=$\frac{0.02L×0.1mol/L}{0.02L}$=0.10mol/L,
故答案为:0.10mol/L;
(4)A.配制标准溶液定容时,加水超过刻度,c(NaOH)偏小,消耗的V(NaOH)偏大,由c(盐酸)=$\frac{c(NaOH)V(NaOH)}{V(盐酸)}$可知,会造成测定结果偏高,故A选;
B.锥形瓶水洗后直接装待测液,对实验无影响,故B不选;
C.酸式滴定管水洗后未用待测稀盐酸溶液润洗,n(HCl)偏小,V(NaOH)偏小,由c(盐酸)=$\frac{c(NaOH)V(NaOH)}{V(盐酸)}$可知,会造成测定结果偏低,故C不选;
D.滴定到达终点时,仰视读出滴定管读数,耗V(NaOH)偏大,由c(盐酸)=$\frac{c(NaOH)V(NaOH)}{V(盐酸)}$可知,会造成测定结果偏高,故D选;
E.碱式滴定管尖嘴部分有气泡,滴定后消失,V(NaOH)偏大,由c(盐酸)=$\frac{c(NaOH)V(NaOH)}{V(盐酸)}$可知,会造成测定结果偏高,故E选;
故答案为:ADE.
点评 本题考查中和滴定实验,为高频考点,把握仪器的使用、滴定原理、数据处理及误差分析为解答的关键,侧重分析与实验能力的考查,注意结合计算式分析误差,题目难度不大.


 名师指导期末冲刺卷系列答案
名师指导期末冲刺卷系列答案科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源:2016-2017学年甘肃省高二上第一次学段考试化学卷(解析版) 题型:填空题
某温度时,在2 L密闭容器中,三种气态物质X、Y、Z的物质的量(n)随时间(t)变化的曲线如图所示,由图中数据分析可得:

(1)该反应的化学方程式为 。
(2)反应开始至2 min,用Y表示的平均反应速率为 ,X的转化率为 。
(3)在密闭容器里,通入a mol A(g)和b mol B(g),发生反应A(g)+ B(g)= 2C(g),当改变下列条件时,会加快反应速率的是 (填序号)。
①降低温度 ②保持容器的体积不变,充入氦气
③加入催化剂 ④保持容器的体积不变,增加A(g)的物质的量
查看答案和解析>>
科目:高中化学 来源:2016-2017学年甘肃省高二上第一次学段考试化学卷(解析版) 题型:选择题
在“绿色化学”工艺中,理想的状态是反应物中的原子全部转化为期望的最终产物,即原子的利用率为100%。下列反应类型中能体现“原子经济性”原则的是( )
①置换反应 ②化合反应 ③分解反应 ④取代反应 ⑤加成反应 ⑥加聚反应
A.①②⑤ B.②⑤⑥ C.③④ D.只有⑥
查看答案和解析>>
科目:高中化学 来源:2016-2017学年甘肃省高二上10月月考化学试卷(解析版) 题型:选择题
物质的量浓度相同的下列溶液中,NH4+浓度最大的是 ( )
A.NH4Cl B. NH4HSO4 C.CH3COONH4 D.NH4HCO3
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
| 物质 | 熔点/℃ | 沸点/℃ | 密度/g•cm-3 | 溶解性 |
| A | -11.5 | 198 | 1.11 | A、B互溶,且均易溶于水 |
| B | 17.9 | 290 | 1.26 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | a=b=c | B. | b>a>c | C. | b>c>a | D. | b=c>a |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题

查看答案和解析>>
科目:高中化学 来源: 题型:解答题
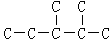 ,此烷烃的一溴代物有6种;若此烷烃由炔烃加氢制得,则此炔烃的结构简式为(CH3)2CH(CH3)CHC≡CH
,此烷烃的一溴代物有6种;若此烷烃由炔烃加氢制得,则此炔烃的结构简式为(CH3)2CH(CH3)CHC≡CH查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com