
现有六种有机物:①乙醇、②苯酚、③溴乙烷、④乙烯、⑤乙酸、⑥甲酸乙酯,其中(填写序号):
(1)一定条件下能发生银镜反应的是________。
(2)一定条件下能发生消去反应的是________。
(3)一定条件下能与H2发生加成反应的是________。
(4)一定条件下能与NaOH溶液发生反应的是______。
科目:高中化学 来源: 题型:
最近,科学家研制出一种纸质电池,这种“软电池”采用薄层纸片作为载体和传导体,在一边附着锌,在另一边附着二氧化锰。电池总反应式为Zn+2MnO2+H2O===ZnO+2MnOOH。下列说法不正确的是( )
A.该电池中Zn为负极,MnO2为正极
B.该电池的正极反应式为MnO2+e-+H2O===MnOOH+OH-
C.导电时外电路电子由Zn流向MnO2,内电路电子由MnO2流向Zn
D.电池工作时水分子和OH-都能通过薄层纸片
查看答案和解析>>
科目:高中化学 来源: 题型:
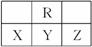 如图为元素周期表中短周期的一部分,若X原子次外层电子数比最外层电子数多3,则下列说法正确的是( )
如图为元素周期表中短周期的一部分,若X原子次外层电子数比最外层电子数多3,则下列说法正确的是( )
A.X的氢化物比R的氢化物稳定
B.原子半径大小顺序是Z>Y>X
C.Y元素能形成两种常见的含氧酸,其中一种是强酸
D.XZ5分子中各原子均满足最外层8电子结构
查看答案和解析>>
科目:高中化学 来源: 题型:
下列关于有机物的正确说法是( )
A.乙烯容易发生取代反应
B.乙烯和苯都能使溴水褪色,褪色原因相同
C.乙烯和乙烷都能发生加聚反应
D.顺2丁烯和反2丁烯的加氢产物相同
查看答案和解析>>
科目:高中化学 来源: 题型:
“达菲”是瑞士罗氏公司研制的有效治疗人类禽流感的药物。达菲的主要合成原料是我国盛产的莽草酸。
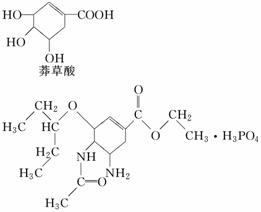
达菲
下列说法不正确的是( )
A.莽草酸可溶于水
B.1 mol莽草酸最多可和4 mol NaOH溶液反应
C.从结构上推测,达菲既可与盐酸反应又可与氢氧化钠溶液反应
D.从结构上推测,以莽草酸为原料合成达菲须经过酯化反应等步骤
查看答案和解析>>
科目:高中化学 来源: 题型:
透明聚酯玻璃钢可用于制造导弹的雷达罩和宇航员使用的氧气瓶。制备它的一种配方中含有下列四种物质:
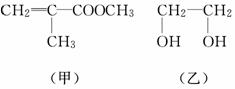
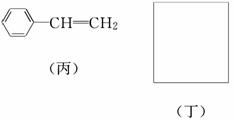
填写下列空白:
(1)甲中不含氧原子的官能团是________;下列试剂能与甲反应而褪色的是________(填标号)。
a.Br2/CCl4溶液 b.石蕊溶液
c.酸性KMnO4溶液
(2)甲的同分异构体有多种,写出其中一种不含甲基的羧酸的结构简式:________。
(3)淀粉通过下列转化可以得到乙(其中A~D均为有机物):
淀粉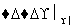 A
A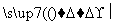 B
B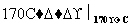 C
C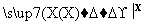 D
D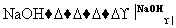 乙
乙
A的分子式是________,试剂X可以是________。
(4)已知:
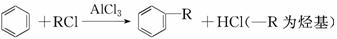
利用上述信息,以苯、乙烯、氯化氢为原料经三步反应合成丙,其中属于取代反应的化学方程式是__________________________________________________________
________________________________________________________________________。
(5)化合物丁仅含碳、氢、氧三种元素,相对分子质量为110。丁与FeCl3溶液作用显现特征颜色,且丁分子中烃基上的一氯取代物只有一种。则丁的结构简式为________。
查看答案和解析>>
科目:高中化学 来源: 题型:
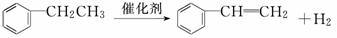
下列营养物质在人体内发生的变化及其对人的生命活动所起的作用叙述不正确的是( )
A.淀粉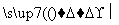 葡萄糖
葡萄糖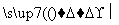 CO2和H2O(释放能量维持生命活动)
CO2和H2O(释放能量维持生命活动)
B.纤维素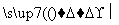 葡萄糖
葡萄糖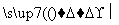 CO2
CO2 和H2O(释放能量维持生命活动)
和H2O(释放能量维持生命活动)
C.油脂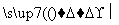 甘油和高级脂肪酸
甘油和高级脂肪酸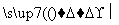 CO2和H2O(释放能量维持生命活动)
CO2和H2O(释放能量维持生命活动)
D.蛋白质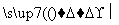 氨基酸合成人体所需的蛋白质(人体生长发育)
氨基酸合成人体所需的蛋白质(人体生长发育)
查看答案和解析>>
科目:高中化学 来源: 题型:
(Ⅰ)某二元酸(H2A)在水中的电离方程式是:H2A===H++HA-,HA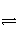
 -H++A2-。
-H++A2-。
(1)Na2A溶液显________(填“酸性”、“中性”或“碱性”)。理由是
________________________________________________________________________
(用离子方程式表示)。
(2)已知0.1 mol/L NaHA溶液的pH=2,则0.1 mol/L H2A溶液中氢离子的物质的量浓度应______0.11 mol/L(填“<”、“>”或“=”),理由是
________________________________________________________________________
________________________________________________________________________。
(Ⅱ)25℃时,A酸溶液的pH=a,B碱溶液的pH=b。
(1)若A为强酸,B为强碱,且a+b=14,若两者等体积混合后,溶液的pH=________,此时溶液中金属阳离子浓度大于酸根阴离子浓度,其原因可能是
________________________________________________________________________。
(2)若A的化学式为HR,B的化学式为MOH,且a+b=14,两者等体积混合后溶液显酸性,则混合溶液中必定有一种离子能发生水解,该离子为__________(填离子符号);混合后的溶液中,下列微粒浓度大小关系一定正确的是____________(填序号)。
①c(MOH)>c(M+)>c(R-)>c(H+)>c(OH-)
②c(HR)>c(M+)>c(R-)>c(OH-)>c(H+)
③c(R-)>c(M+)>c(H+)>c(OH-)
④c(M+)>c(R-)>c(OH-)>c(H+)
⑤c(M+)+c(H+)=c(R-)+c(OH-)
查看答案和解析>>
科目:高中化学 来源: 题型:
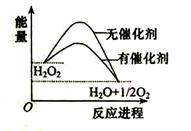 已知H2O2在催化剂作用下分解速率加快,其能量随反应进程的变化如下图所示。下列说法正确的是( )
已知H2O2在催化剂作用下分解速率加快,其能量随反应进程的变化如下图所示。下列说法正确的是( )
A.加入催化剂,减小了反应的热效应
B.加入催化剂,可提高H2O2的平衡转化率
C.H2O2分解的热化学方程式:H2O2 → H2O + O2 + Q
D.反应物的总能量高于生成物的总能量
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com