
ú��������úΪԭ�ϣ�������ѧ�ӹ�ʹúת��Ϊ���塢Һ�塢����ȼ���Լ����ֻ�����Ʒ�Ĺ�ҵ���̡�
��1����ˮ����ͨ�����ȵ�̿���ɲ���ˮú������ӦΪ��C(s)��H2O(g)  CO(g)��H2(g) ��H����131.3 kJ��mol��1һ���¶��£���һ���ݻ��ɱ���ܱ������У�����������Ӧ���������жϸ÷�Ӧ�ﵽ��ѧƽ��״̬���� (����ĸ����ͬ)
CO(g)��H2(g) ��H����131.3 kJ��mol��1һ���¶��£���һ���ݻ��ɱ���ܱ������У�����������Ӧ���������жϸ÷�Ӧ�ﵽ��ѧƽ��״̬���� (����ĸ����ͬ)
A�������е�ѹǿ����
B��1 mol H��H�����ѵ�ͬʱ����2 mol H��O��
C��v��(CO)��v��(H2O)
D��c(CO)��c(H2)
��2������ͬ����CO(g)��H2O(g)�ֱ�ͨ�뵽���Ϊ2 L�ĺ����ܱ������У����з�ӦCO(g)��H2O(g)  CO2(g)��H2(g)���õ������������ݣ�
CO2(g)��H2(g)���õ������������ݣ�
| ʵ �� �� | �� �� /�� | ��ʼ��/mol | ƽ����/mol | �ﵽƽ������ʱ��/min | ||
| H2O | CO | H2 | CO | |||
| 1 | 650 | 2 | 4 | 1.6 | 2.4 | 5 |
| 2 | 900 | 1 | 2 | 0.4 | 1.6 | 3 |
| 3 | 900 | a | b | c | d | t |
 CH3OH(g) +H2O(g)����ͼ��ʾ�÷�Ӧ���й���������(��λΪkJ��mol��1)�ı仯�������Ϊ1 L�ĺ����ܱ������У�����1 mol CO2��3 mol H2�� ���д�ʩ����ʹ c(CH3OH)�������
CH3OH(g) +H2O(g)����ͼ��ʾ�÷�Ӧ���й���������(��λΪkJ��mol��1)�ı仯�������Ϊ1 L�ĺ����ܱ������У�����1 mol CO2��3 mol H2�� ���д�ʩ����ʹ c(CH3OH)������� 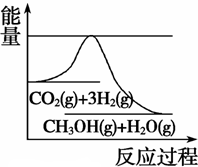
(1)B��C (2) �� ���ȣ� ��b=2a����a>1 (3)C��D
�������������(1)���ڷ�ӦC(s)��H2O(g)  CO(g)��H2(g)������Ӧ�Ǹ������������ķ�Ӧ��A������Ӧδ�ﵽƽ�⣬�������е�ѹǿ�ᷢ���ı䣬����Ӧ�ﵽ��ƽ�⣬�������������ѹǿ���䡣��ȷ��B��1 mol H��H�����Ѿͻ����1mol��ˮ�����γ���2mol��H��O������ͬʱ����2 mol H��O����˵������ͬ��������˵����λʱ�������������������ȡ���Ӧ�ﵽƽ�⡣��ȷ��D��CO��H2����������ڷ���ʽ�ж��ߵ�ϵ����ͬ���������κ�ʱ����c(CO)��c(H2)���ʲ���ȷ����Ӧ�ﵽƽ�⡣��������ѡ��ΪB C����2���� ��ӦCO(g)��H2O(g)
CO(g)��H2(g)������Ӧ�Ǹ������������ķ�Ӧ��A������Ӧδ�ﵽƽ�⣬�������е�ѹǿ�ᷢ���ı䣬����Ӧ�ﵽ��ƽ�⣬�������������ѹǿ���䡣��ȷ��B��1 mol H��H�����Ѿͻ����1mol��ˮ�����γ���2mol��H��O������ͬʱ����2 mol H��O����˵������ͬ��������˵����λʱ�������������������ȡ���Ӧ�ﵽƽ�⡣��ȷ��D��CO��H2����������ڷ���ʽ�ж��ߵ�ϵ����ͬ���������κ�ʱ����c(CO)��c(H2)���ʲ���ȷ����Ӧ�ﵽƽ�⡣��������ѡ��ΪB C����2���� ��ӦCO(g)��H2O(g)  CO2(g)��H2(g)��650��ʱ����ʼʱn(CO)=4mol��n(H2O)=2mol��n(CO2)=0��n(H2)=0.����Ӧ�ﵽƽ��ʱ�������ʵ����ʵ���Ϊn(CO)=4mol��1.6mol=2.4mol��n(H2O)=2mol��1.6mol=0.4mol,n(CO2)=1.6mol��n(H2)=1.6mol�����ڸ÷�Ӧ��˵������ϵ������1�����Դﵽƽ��״̬ʱ��ƽ�ⳣ��Ϊ
CO2(g)��H2(g)��650��ʱ����ʼʱn(CO)=4mol��n(H2O)=2mol��n(CO2)=0��n(H2)=0.����Ӧ�ﵽƽ��ʱ�������ʵ����ʵ���Ϊn(CO)=4mol��1.6mol=2.4mol��n(H2O)=2mol��1.6mol=0.4mol,n(CO2)=1.6mol��n(H2)=1.6mol�����ڸ÷�Ӧ��˵������ϵ������1�����Դﵽƽ��״̬ʱ��ƽ�ⳣ��Ϊ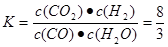 ����900��ʱ����ʼʱn(CO)=2mol��n(H2O)=1mol��n(CO2)=0��n(H2)=0.����Ӧ�ﵽƽ��ʱ�������ʵ����ʵ���Ϊn(CO)= 1.6mol��n(H2O)=1mol��0.4mol=0.6mol,n(CO2)=0.4mol��n(H2)=0.4mol�����ڸ÷�Ӧ��˵������ϵ������1�����Դﵽƽ��״̬ʱ��Ũ�ȱ�Ϊ���ʵ����ıȡ������ڸ��¶���ƽ�ⳣ��Ϊ
����900��ʱ����ʼʱn(CO)=2mol��n(H2O)=1mol��n(CO2)=0��n(H2)=0.����Ӧ�ﵽƽ��ʱ�������ʵ����ʵ���Ϊn(CO)= 1.6mol��n(H2O)=1mol��0.4mol=0.6mol,n(CO2)=0.4mol��n(H2)=0.4mol�����ڸ÷�Ӧ��˵������ϵ������1�����Դﵽƽ��״̬ʱ��Ũ�ȱ�Ϊ���ʵ����ıȡ������ڸ��¶���ƽ�ⳣ��Ϊ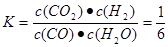 �������¶ȣ���ѧƽ�ⳣ����С��˵�������¶ȣ���ѧƽ�����淴Ӧ�����ƶ�������ƽ���ƶ�ԭ���������¶ȣ���ѧƽ�������ȷ�Ӧ�����ƶ����淴Ӧ����Ϊ���ȷ�Ӧ������ʵ��3Ҫ�ﵽ��ʵ��2��ͬ��ƽ��״̬(�������ʵ����������ֱ����)����t<3 min����Ϊ��Ӧ��ƽ��״̬��ͬ��������ʽ��ϵ����ͬ������ֻҪ��Ӧ������ʵ����ı���ԭƽ�����ʼʱ�����ʵ����ı���ͬ�������ߵ����ʵ����ı�Ϊa:b=1:2��ƽ�ⲻ�����ƶ���������������ѹǿ����Ӧ������ʵ���Ũ������ѧ��Ӧ���ʼӿ죬�ﵽƽ������Ҫ��ˮ�����̡�(3)��ͼ����Կ����÷�ӦΪ���ȷ�Ӧ��A�������¶ȡ�����ƽ���ƶ�ԭ������ѧƽ�����淴Ӧ�����ƶ���c(CH3OH)��С������B������N2���Ƿ�Ӧ��ϵ�����壬����N2(g)��ʹ��ϵѹǿ�����Ƿ�Ӧ������и����ʵ�Ũ�Ȳ��䣬����ƽ�ⲻ�����ƶ���c(CH3OH)���䡣����C. ��H2O(g)����ϵ�з������,��С�������Ũ�ȣ�ƽ�������ƶ���c(CH3OH)������ȷ��D�����ٳ���0.5 mol CO2��1.5 mol H2������Ӧ���Ũ�ȣ���ѧƽ�������ƶ���c(CH3OH)������ȷ��
�������¶ȣ���ѧƽ�ⳣ����С��˵�������¶ȣ���ѧƽ�����淴Ӧ�����ƶ�������ƽ���ƶ�ԭ���������¶ȣ���ѧƽ�������ȷ�Ӧ�����ƶ����淴Ӧ����Ϊ���ȷ�Ӧ������ʵ��3Ҫ�ﵽ��ʵ��2��ͬ��ƽ��״̬(�������ʵ����������ֱ����)����t<3 min����Ϊ��Ӧ��ƽ��״̬��ͬ��������ʽ��ϵ����ͬ������ֻҪ��Ӧ������ʵ����ı���ԭƽ�����ʼʱ�����ʵ����ı���ͬ�������ߵ����ʵ����ı�Ϊa:b=1:2��ƽ�ⲻ�����ƶ���������������ѹǿ����Ӧ������ʵ���Ũ������ѧ��Ӧ���ʼӿ죬�ﵽƽ������Ҫ��ˮ�����̡�(3)��ͼ����Կ����÷�ӦΪ���ȷ�Ӧ��A�������¶ȡ�����ƽ���ƶ�ԭ������ѧƽ�����淴Ӧ�����ƶ���c(CH3OH)��С������B������N2���Ƿ�Ӧ��ϵ�����壬����N2(g)��ʹ��ϵѹǿ�����Ƿ�Ӧ������и����ʵ�Ũ�Ȳ��䣬����ƽ�ⲻ�����ƶ���c(CH3OH)���䡣����C. ��H2O(g)����ϵ�з������,��С�������Ũ�ȣ�ƽ�������ƶ���c(CH3OH)������ȷ��D�����ٳ���0.5 mol CO2��1.5 mol H2������Ӧ���Ũ�ȣ���ѧƽ�������ƶ���c(CH3OH)������ȷ��
���㣺���黯ѧƽ��״̬���жϡ���Ӧ�ȵļ��㼰��������Ի�ѧƽ���ƶ���Ӱ���֪ʶ��



| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ�� ���ͣ������
(8��)ijѧ��Ϊ��̽��п�����ᷴӦ�����е����ʱ仯������100 mLϡ�����м���������п�ۣ�����ˮ�������ռ���Ӧ�ų���������ʵ���¼����(�ۼ�ֵ�����������Ϊ������)��
| ʱ��(min) | 1 | 2 | 3 | 4 | 5 |
| �������(mL) | 50 | 120 | 232 | 290 | 310 |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ������
��17�֣�����̫����CO2��������Ч��������CO2���ǿ�ѧ���о�����Ҫ���⡣
��1����ȼú�����е�CO2ת��Ϊ�����ѵķ�Ӧԭ��Ϊ��
2CO2��g��+6H2��g�� CH3OCH3��g��+3H2O��g�� ��H=-122��4kJ��mol��1
CH3OCH3��g��+3H2O��g�� ��H=-122��4kJ��mol��1
��ij�¶��£���2��0molCO2��g����6��0molH2��g����������ɱ���ܱ������У���Ӧ����ƽ��ʱ���ı�ѹǿ���¶ȣ�ƽ����ϵ��CH3OCH3��g�������ʵ��������仯���±���ʾ��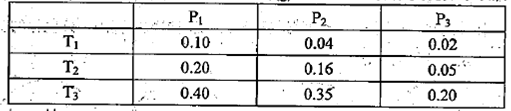
��Pl P3���>����<����=������ͬ������T1��Pl��T3��P3ʱƽ�ⳣ���ֱ�ΪK1��K3��
��K1 K3��T1��PlʱH2��ƽ��ת����Ϊ ��
��һ�������£�t������Ӧ���ܱ������д�ƽ�⡣�����ı�Ӱ�췴Ӧ��һ����������������б仯��˵��ƽ��һ��������Ӧ�����ƶ�����____ ��
A����Ӧ���Ũ�Ƚ��� B��������ѹǿ����
C������Ӧ���ʴ����淴Ӧ���� D����ѧƽ�ⳣ��K����
��2��̼�������Һ��ˮϡ�ͣ�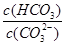 ����������䡱��С��������̼�����Һ���տ�����CO2�����ܶɳ�����ʱ�����й�ϵ��˵����ȷ���� ��
����������䡱��С��������̼�����Һ���տ�����CO2�����ܶɳ�����ʱ�����й�ϵ��˵����ȷ���� ��
A��c��K+��=2c��CO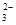 ��+c��HCO
��+c��HCO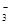 ��+c��H2CO3��
��+c��H2CO3��
b��c��HCO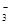 ��
�� c��CO
c��CO ��
��
c�������¶ȣ�c��H+����c��OH��������
��3����ʢ��FeCl3��Һ���Թ��еμ�����̼�����Һ�������������壬��Һ��ɫ����ü���������ܲ��������ЧӦ����Ӧ�����ӷ���ʽΪ ��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ������
������16�֣����ʹ�����CO2�ĺ�������Ч�ؿ�������CO2����Ϊ�о�����Ҫ���⡣
��1����֪�ڳ��³�ѹ�£�
�� 2CH3OH(l) �� 3O2(g) �� 2CO2(g) �� 4H2O(g) ��H ����1275.6 kJ/mol
�� 2CO (g)+ O2(g) �� 2CO2(g) ��H ����566.0 kJ/mol
�� H2O(g) �� H2O(l) ��H ����44.0 kJ/mol
д���״�����ȫȼ������һ����̼��Һ̬ˮ���Ȼ�ѧ����ʽ�� ��
��2�����ݻ�Ϊ2L���ܱ������У�����2mol CO2��6mol H2�����¶�500��ʱ������Ӧ��
CO2��g��+ 3H2��g��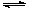 CH3OH��g��+ H2O��g�� ��H<0��CH3OH��Ũ����ʱ��仯��ͼ���ش��й����⣺
CH3OH��g��+ H2O��g�� ��H<0��CH3OH��Ũ����ʱ��仯��ͼ���ش��й����⣺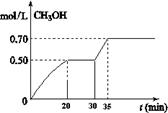
�ٴӷ�Ӧ��ʼ��20����ʱ��H2��ƽ����Ӧ����v(H2)��_________________��
�ڴ�30���ӵ�35���Ӵﵽ�µ�ƽ�⣬�ı������������ ��
A. ����ѹǿ B.������� C.�����¶� D.����Ӧ���Ũ��
����ʽ����÷�Ӧ��35���Ӵﵽ��ƽ��ʱ��ƽ�ⳣ��(����2λС��)
�������30����ʱ,���������г���2mol CO2��6mol H2�������¶Ȳ��䣬�ﵽ��ƽ��ʱ��CH3OH��Ũ��____________1mol.L-1(�>������<����=��)��
��3��һ��ԭ��صĹ���ԭ��Ϊ��2Na2S2 + NaBr3  Na2S4 + 3NaBr���øõ��Ϊ��Դ������������ˮ��Һ������ʽ��е�⣬ʹCO2��ͭ�缫�Ͽ�ת��Ϊ���顣
Na2S4 + 3NaBr���øõ��Ϊ��Դ������������ˮ��Һ������ʽ��е�⣬ʹCO2��ͭ�缫�Ͽ�ת��Ϊ���顣
�ٸõ�ظ����ĵ缫��ӦʽΪ�� ��
�ڵ����в���CH4һ���ĵ缫��ӦʽΪ�� ��
��4����ͼ��NaOH����CO2��ij�ֲ����ˮ��Һ��pH��0��14�ķ�Χ��H2CO3��HCO3����CO32�����ֳɷ�ƽ��ʱ����ɷ�����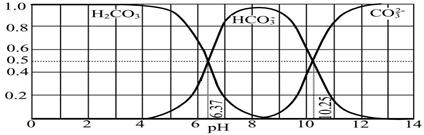
����������ȷ���� ��
A����ͼ��1.0 mol��L-1̼������Һ�ζ�1.0 mol��L-1 HCl��Һ�ĵζ�����
B����pH�ֱ�Ϊ6.37��10.25ʱ����Һ��c(H2CO3)=c(HCO3��)=c(CO32��)
C������ѪҺ��pHԼΪ7.4����CO2��ѪҺ�ж���HCO3����ʽ����
D������CO2��NaOH��Ӧ��ȡNaHCO3���˿�����Һ��pHΪ7��9֮��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ������
(9��)��֪A(g)+B(g)  C(g)+D(g)��Ӧ��ƽ�ⳣ�����¶ȵĹ�ϵ���£�
C(g)+D(g)��Ӧ��ƽ�ⳣ�����¶ȵĹ�ϵ���£�
| |�¶�/ �� | 700 | 900 | 830 | 1000 | 1200 |
| ƽ�ⳣ�� | 1.7 | 1.1 | 1.0 | 0.6 | 0.4 |
 A(g)+B(g)��ƽ�ⳣ����ֵΪ ��
A(g)+B(g)��ƽ�ⳣ����ֵΪ ���鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ������
һ���¶��£����ܼ�Ϊ1L���ܱ������ڷ���2molN2O4��8molNO2���������·�Ӧ2 NO2(����ɫ) N2O4(��ɫ) ��H��0��Ӧ��NO2��N2O4�����ʵ����淴Ӧʱ��仯����������ͼ��������Ҫ������
N2O4(��ɫ) ��H��0��Ӧ��NO2��N2O4�����ʵ����淴Ӧʱ��仯����������ͼ��������Ҫ������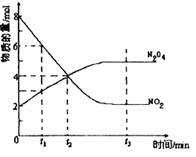
��1���ڸ��¶��£���Ӧ�Ļ�ѧƽ�ⳣ������ʽΪ�� ��
��2����t1��10s��t2��20s�������t1��t2ʱ��N2O4��ʾ�ķ�Ӧ���ʣ� mol�� L-1�� s-1��
��3��ͼ��t1��t2��t3��һ��ʱ�̱�ʾ��Ӧ�Ѿ��ﵽƽ�⣿�� ��
��4��t1ʱ������Ӧ���� ����������������������淴Ӧ���ʡ�
��5��ά���������¶Ȳ��䣬����С�������������ƽ���� �ƶ��������Ӧ�������淴Ӧ�����䡱��
��6��ά��������������䣬�����¶ȣ��ﵽ��ƽ��ʱ��ϵ����ɫ ������������dz�����䡱����
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ������
������;ʮ�ֹ㷺����ҵ�Ϻϳ�����ʱ����SO2ת��Ϊ��������һ���ؼ����衣��ش��������⣺
��1���÷�Ӧ�ں��º����ܱ������н��У��ж���ﵽƽ��״̬�ı�־��������������ĸ��
a��SO2��SO3Ũ�����
b��SO2�ٷֺ������ֲ���
c�������������ѹǿ����
d��SO3������������SO2�������������
e�������л��������ܶȱ��ֲ���
��2��ij�¶��£�2SO2(g)��O2(g�� 2SO3(g�� ��H����196 kJ?mol��1����һ���̶��ݻ�Ϊ5 L���ܱ������г���0.20 mol SO2��0.10 mol O2������Ӻ�ﵽƽ�⣬��������к�SO3Ϊ0.18 mol����v(O2)���� ��mol?L��1?min��1���ų�������Ϊ�� �� kJ��
2SO3(g�� ��H����196 kJ?mol��1����һ���̶��ݻ�Ϊ5 L���ܱ������г���0.20 mol SO2��0.10 mol O2������Ӻ�ﵽƽ�⣬��������к�SO3Ϊ0.18 mol����v(O2)���� ��mol?L��1?min��1���ų�������Ϊ�� �� kJ��
��3��һ���¶�ʱ��SO2��ƽ��ת����(��)����ϵ��ѹǿ(p)�Ĺ�ϵ��ͼ��ʾ���Է�����ҵ�����в��ó�ѹ��ԭ������ ����
��4����һ������SO2��0.7 molO2����һ��������ܱ������У���550��ʹ��������·�����Ӧ����Ӧ�ﵽƽ��������еĻ������ͨ������NaOH��Һ���������������21.28 L���ٽ�ʣ������ͨ������ûʳ����ļ�����Һ����O2�����������ּ�����5.6 L(�������������Ϊ��״���µ����)����÷�Ӧ�ﵽƽ��ʱSO2��ת�����Ƕ��٣���Ҫд��������̣�����������һλС������
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ������
���淴Ӧ��aA(g)��bB(g) cC(g)��dD(g)����H��Q���Ը���ͼ�ش�
cC(g)��dD(g)����H��Q���Ը���ͼ�ش�
(1)ѹǿp1��p2________(�����С��)��
(2)(a��b)��(c��d)________(�������)��
(3)�¶�t1���t2��________(��ߡ������͡�)��
(4)Qֵ��________(�������������)��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ������
ij�¶�ʱ��2L������X��Y��Z������̬���ʵ����ʵ�����n����ʱ�䣨t���仯��������ͼ��ʾ����ͼ�����ݷ�����
��1���÷�Ӧ�Ļ�ѧ����ʽΪ��
��2����Ӧ��ʼ��2min����X��ʾ��ƽ����Ӧ����Ϊ��
��3������������˵��������Ӧ�ﵽ��ѧƽ��״̬���� ������ĸ��
A���������������ʵ�������ʱ��ı仯���仯
B����λʱ����ÿ����3mol X��ͬʱ����2mol Z
C��������������������ʱ��ı仯���仯
��4�����ܱ������ͨ��a mol X(g)��b mol Y(g)��������ӦX(g��+ Y(g��=2Z(g)�����ı���������ʱ����Ӧ���ʻᷢ��ʲô�仯��ѡ������� ��С�� ���䡱��
�� �����¶ȣ�
�ڱ���������������䣬����X(g)�����ʵ�����
�� ���������������
�鿴�𰸺ͽ���>>
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com