
(14分)下表为元素周期表的一部分:
 族 族周期 | | | | |||||
| 1 | ① | | | | | | | |
| 2 | | | | | | ② | | |
| 3 | ③ | | | ④ | | ⑤ | ⑥ | |
(14分)
Ⅰ.⑴第三周期ⅣA族;(1分) ⑵ Na>S>O ;(2分)
⑶ HCl>H2S>SiH4 ;(2分) ⑷ Na+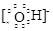 、
、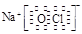 ;(2分)
;(2分)
Ⅱ.⑴ 2Na2O2 + 2H2O = 4Na+ + 4OH-+ O2↑;(2分)
⑵ NaHSO3;(1分) c(Na+)>c(HSO )>c(H+)>c(SO
)>c(H+)>c(SO )>c(OH-) ;(2分)
)>c(OH-) ;(2分)
⑶ D 。(2分)
解析试题分析:Ⅰ.根据元素周期表的结构判断①②③④⑤⑥分别是H、O、Na、Si、S、Cl元素。
(1)元素④Si在周期表中的位置是第三周期ⅣA族;
(2)②③⑤的原子半径由大到小的顺序为Na、S在第三周期,O在第二周期,Na在S的右侧,所以原子半径:Na>S>O;
(3)④⑤⑥元素的非金属性强弱顺序是Si<S<Cl,所以气态氢化物的稳定性由强到弱的顺序是HCl>H2S>SiH4;
(4)①②③⑥中的某些元素可形成既含离子键又含极性共价键的化合物,如NaOH、NaClO、NaClO3等,电子式为Na+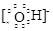 、
、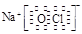 ;
;
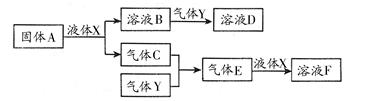
Ⅱ.(1)A是一种淡黄色固体,由A能与某种液体反应,说明A是过氧化钠,该液体是水,二者反应的化学方程式为2Na2O2 + 2H2O = 4Na+ + 4OH-+ O2↑;
(2)溶液B是氢氧化钠溶液,气体C是氧气,气体Y是一种大气污染物,直接排放会形成酸雨。说明气体Y是二氧化硫。二氧化硫与氢氧化钠1:1完全反应时的产物根据元素守恒法可判断为NaHSO3;NaHSO3溶液显酸性,说明HSO3-的电离程度大于其水解程度,所以溶液中的离子浓度的大小关系是c(Na+)>c(HSO3-)>c(H+)>c(SO32-)>c(OH-);
(3)F为硫酸,100 mL 18 mol/L的硫酸浓溶液中硫酸的物质的量是1.8mol,浓硫酸与Cu完全反应,最多生成0.9mol的二氧化硫,但随着反应的进行,硫酸浓度变稀,Cu不与稀硫酸反应,所以产生的二氧化硫的物质的量小于0.9mol,体积(标准状况)则小于20.16L,所以答案选D。
考点:考查对元素周期表的应用,元素判断及性质应用,电子式、离子方程式的书写,物质推断,溶液中离子浓度的比较,氧化还原反应的计算


 智能训练练测考系列答案
智能训练练测考系列答案科目:高中化学 来源: 题型:填空题
决定物质性质的重要因素是物质的结构。请回答下列问题:
(1)已知A和B为第三周期元素,其原子的第一至第四电离能如下表所示:
| 电离能/kJ·mol-1 | I1 | I2 | I3 | I4 |
| A | 578 | 1817 | 2745 | 11578 |
| B | 738 | 1451 | 7733 | 10540 |
 与光的频率v的关系为
与光的频率v的关系为 ,其中光速c=3×108m·s-1。根据下表有关蛋白质分子中重要化学键的信息,求波长为300 nm的紫外光的光子所具有的能量 kJ·mol-1,说明人体长时间照射紫外光后皮肤是否会受伤害的原因:
,其中光速c=3×108m·s-1。根据下表有关蛋白质分子中重要化学键的信息,求波长为300 nm的紫外光的光子所具有的能量 kJ·mol-1,说明人体长时间照射紫外光后皮肤是否会受伤害的原因: | 共价键 | C—C | C—N | C—S |
| 键能/kJ·mol-1 | 347 | 305 | 259 |
| 离子晶体 | NaCl | KCl | CaO |
| 晶格能/kJ·mol-1 | 786 | 715 | 3401 |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
(13分)Ⅰ.通常状况下,X、Y和Z是三种气态单质。X的组成元素是第三周期原子半径最小的元素(稀有气体元素除外);Y和Z均由元素R组成,反应Y+2I-+2H+====I2+Z+H2O常作为Y的鉴定反应。W是短周期元素,最外层电子数是最内层电子数的三倍,吸引电子对的能力比X单质的组成元素要弱。
(1) Z的化学式__________________
(2)将Y和二氧化硫分别通入品红溶液,都能使品红褪色。简述用褪色的溶液区别Y和二氧化硫的实验方法:________________________________________________________。
(3)举出实例说明X的氧化性比W单质氧化性强(仅用一个化学方程式表示):_____________。
Ⅱ.如图是0.1 mol·L-1四种电解质溶液的pH随温度变化的图像。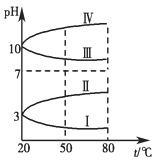
(1)其中符合0.1 mol·L-1NH4Al(SO4)2的pH随温度变化的曲线是________(填写序号),
(2)20 ℃时,0.1 mol·L-1NH4Al(SO4)2中2c(SO42-)-c(NH4+)-3c(Al3+)=________。(计算精确值)
(3)室温时,向100 mL 0.1 mol·L-1 NH4HSO4溶液中滴加0.1 mol·L-1 NaOH溶液,得到溶液pH与NaOH溶液体积的关系曲线如图所示: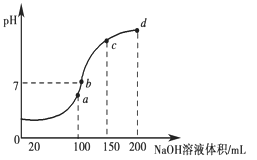
试分析图中a、b、c、d四个点,水的电离程度最大是________点;在b点,溶液中各离子浓度由大到小的排列顺序是______________________
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
(14分)下表列出了A—R九种元素在周期表中的位置,用元素符号或化学式填空。
 主族 主族周期 | ⅠA | ⅡA | ⅢA | ⅣA | ⅤA | ⅥA | ⅦA | 0 |
| 2 | | | | E | | F | | |
| 3 | A | C | D | | | | G | R |
| 4 | B | | | | | | H | |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
某微粒的结构示意图为 , 试回答:
, 试回答:
(1)当x-y=10时,该粒子为 (选填“原子”或“阳离子”、“阴离子”)。
(2)当y=8时,该粒子可能是(用化学式表示,任填3种) 、 、 。
(3)请写出实验室制取y=7时元素对应单质的离子方程式: 。
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
A、B、C、D、E是核电荷数依次增大的五种短周期主族元素,A元素的原子核内只有1个质子,B元素的原子半径是其所在主族中最小的,B的最高价氧化物对应水化物的化学式为HBO3;C元素原子的最外层电子数比次外层多4个;C的阴离子与D的阳离子具有相同的电子排布,两元素可形成化合物D2C;C、E同主族.
(1)D在周期表中的位置 ;B的原子核外电子排布示意图 ;
(2)E元素形成最高价氧化物对应水化物的化学式为 ;
(3)元素C、D、E形成的原子半径大小关系是 (用元素符号表示)。
(4)C、D可形成化合物D2C2,D2C2含有的化学键是 ;
(5)A、C两种元素形成的原子个数之比为1:1的化合物电子式 ;
(6)B的氢化物与B的最高价氧化物的水化物反应的离子方程式 。
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
原子序数由小到大排列的四种短周期元素X、Y、Z、W,四种元素的原子序数之和为32,在周期表中X是原子半径最小的元素,Y、Z左右相邻,Z、W位于同主族。
(1)X元素是 (填名称) ,W在周期表中的位置 。
(2)X与Y 形成化合物的电子式为 ,X与W组成的化合物中存在 键(填“离子”“共价”)。
(3)①写出实验室制备YX3的化学方程式: 。
②工业上也可以选择合适的条件进行YX3的合成,若已知在该条件下每生成2molYX3气体时放出
92.4kJ的热量,写出该反应的热化学方程式 。
(4)由X、Y、Z、W四种元素组成的一种离子化合物A。已知1mol A能与足量NaOH浓溶液反应生成标准状况下44.8L气体。则A的名称是 。
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
A、B、C、D四种短周期元素,原子序数依次增大,A原子的最外层上有4个电子;B的阴离子和C的阳离子具有相同的电子层结构,两元素的单质反应,能生成一种淡黄色的固体E;D的L层电子数等于K、M两个电子层上的电子数之和。
(1)A为 ,B为 ,C为 ,D为 。(填元素符号)
(2)D的最高价氧化物的水化物的化学式是 ,E的电子式是 。
(3)写出由A、B组成的化合物与E反应的化学方程式: 。
(4)请用电子式表示出C和D形成的化合物F的形成过程: 。
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
A、B、C、D是四种短周期元素,它们的原子序数依次增大,其中,A、C及B、D分别是同主族元素;A元素的原子半径是所有主族元素中原子半径最小的;B、D两元素的原子核中质子数之和是A、C两元素原子核中质子数之和的2倍;四种元素所形成的单质中A、B单质是气体,C、D单质是固体。
(1)写出以下元素的名称: B ;C 。
(2)用化学方程式表示C2D的形成过程: 。
(3)实验室常用A、B两元素所形成的原子个数为1:1的化合物来制备一种常见气体,其化学方程式为 。此实验中常加入一种黑色粉未物质,其作用是 。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com