
请从图中选用必要的装置进行电解饱和食盐水的实验,要求测定产生的氢气的体积(大于25mL),并检验氯气的氧化性。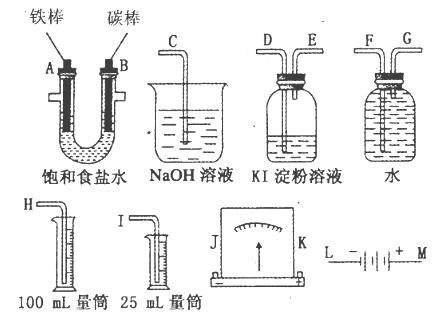
(1)A极发生的电极反应式是_____________________·B极发生的电极反应式是_______________________;电解饱和食盐水的化学方程式是______________________。
(2)电源的M端应连接的电极为____________(A或B)极。
(3)设计上述气体实验装置时,各接口的正确连接顺序为:______________________________
__________________________________(填接口编号)。
(4)实验中,在盛有KI淀粉溶液的容器中发生反应的离子方程式为________________。
(5)已知饱和食盐水50mL,某时刻测得H2体积为56mL(标准状况)。此时溶液pH约为___________________。
(1)2 H++2e-=H2↑;(2分) 2 Cl--2e-= Cl2↑(2分)
2NaCl+2H2O 2NaOH+ H2↑+ Cl2↑(2分)
2NaOH+ H2↑+ Cl2↑(2分)
(2)B(2分)
(3)H、F、G、A、B、D、E、C(2分)
(4)Cl2+2I-="2" Cl-+2I2(2分)
(5)13(2分)
解析试题分析:(1)A极应作阴极,H+放电,电极反应式是2 H++2e-=H2↑,B极是阳极,Cl-放电,电极反应式是2 Cl--2e-= Cl2↑电解饱和食盐水的化学方程式是2NaCl+2H2O 2NaOH+ H2↑+ Cl2↑;
2NaOH+ H2↑+ Cl2↑;
(2)M是正极应连接阳极B极,
(3)收集氢气用排水集气法,所以A→G→F→H,验证氯气的氧化性用淀粉碘化钾溶液,剩余氯气用氢氧化钠溶液吸收,所以B→D→E→C,整体连起来为H、F、G、A、B、D、E、C;
(4)在盛有KI淀粉溶液的容器中发生反应是氯气置换碘的反应,离子方程式为Cl2+2I-="2" Cl-+2I2
(5)n(H2)=0.0025mol,所以n(NaOH)=0.005mol,c(NaOH)=0.1mol/L,pH=13.
考点:考查电解饱和食盐水的实验所涉及的电解原理、装置连接、电极反应、pH的计算


 能考试期末冲刺卷系列答案
能考试期末冲刺卷系列答案科目:高中化学 来源: 题型:填空题
运送“神舟五号”飞船的火箭燃料除液态双氧水外,还有另一种液态氮氢化合物。已知该化合物中氢元素的质量分数为12. 5%,相对分子质量为32,结构分析发现该分子结构中只有单键。
(1)该氮氢化合物的电子为 。
(2)若该物质与液态双氧水恰好完全反应,产生两种无毒又不污染环境的气态物质,写出该反应的化学方程式 。
(3)NH3分子中的N原子有一对孤对电子,能发生反应:NH3+HCl=NH4Cl。试写出上述氮氢化合物通入足量盐酸时,发生反应的化学方程式
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
硅单质及其化合物应用很广。请回答下列问题:
(1)制备硅半导体材料必须先得到高纯硅。三氯甲硅烷(SiHCl3)还原法是当前制备高纯硅的主要方法,生产过程示意图如下: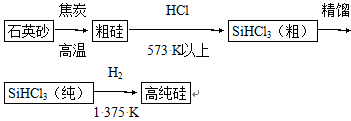
①写出由纯SiHCl3制备高纯硅的化学反应方程式____________________。
②整个制备过程必须严格控制无水、无氧。SiHCl3遇水剧烈反应生成H2SiO3、HCl和另一种物质,写出配平的化学反应方程式____________________;H2还原SiHCl3过程中若混有O2,可能引起的后果是____________________。
(2)下列有关硅材料的说法正确的是 ( )。
A.单质硅化学性质稳定,但可以被强碱溶液腐蚀
B.盐酸可以与硅反应,故采用盐酸为抛光液抛光单晶硅
C.普通玻璃是由纯碱、石灰石和石英砂制成的,其熔点很高
D.光导纤维的主要成分是SiO2
(3)硅酸钠水溶液俗称水玻璃。取少量硅酸钠溶液于试管中,逐滴加入盐酸,振荡。写出实验现象并给予解释(用化学方程式说明)_________________________ ____。
(4)在人体器官受到损伤时,需要使用一种新型无机非金属材料来植入体内,这种材料是________(填字母)。
A.高温结构陶瓷 B.生物陶瓷 C.导电陶瓷
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
为了防治酸雨,减少煤燃烧时向大气排放的SO2,工业上采用生石灰和含硫的煤混合使用以“固硫”(避免硫的化合物进入大气),最后生成石膏。试回答:
(1)整个“固硫”反应所涉及的反应类型包括:①化合反应②分解反应 ③置换反应 ④复分解反应 ⑤氧化还原反应 ⑥非氧化还原反应 ⑦离子反应 ⑧非离子反应(分子反应)。其中正确的是( )。
A.①⑤⑥⑦ B.①②③⑤⑧ C.①⑤⑥⑧ D.②④⑤⑦
(2)第一步“固硫”反应的化学方程式中所需气态物质的化学计量数为( )
A.1 B.2 C.3 D.4
(3)比较此法与石灰石粉末与含硫煤混合法哪个更好些________(A.生石灰 B.石灰石),原因是________。
(4)你认为减少酸雨产生可采取的措施是( )。
①少用煤作燃料 ②把工厂的烟囱造高 ③先将燃料煤脱硫 ④在土壤中加石灰防止酸化 ⑤开发新能源,避免含S、N的氧化物大量排放
A.①②③ B.②③④⑤ C.①③⑤ D.①③④⑤
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
利用图所示装置收集以下4种气体(图中烧瓶的位置不得变化)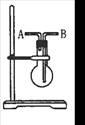
①NO ②Cl2 ③NH3 ④SO2 (写序号)
(1)若烧瓶是干燥的,则由B口进气收集的气体有________;
(2)若烧瓶是干燥的,则由A口进气,可收集的气体有_______。
(3)若烧瓶充满水,可收集的气体有________,这时气体由________进入。
(4)若在烧瓶内装入浓硫酸使气体干燥,则可用此装置来干燥的气体有_____ ___,这时气体由________口进入。
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
下图①—⑩分别代表有关反应中的一种物质,其中③气体能使酚酞试液变红,⑦是红综色气体,回答: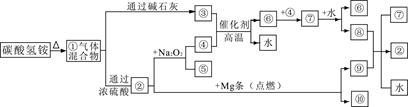
(1)①中的混合气体通过浓硫酸发生化学反应,主要生成物的化学式是 。
(2)写出碳酸氢铵中阳离子的检验方法 。
(3)写出工业上合成③的化学方程式 。
(4)⑧与⑨反应的化学方程式是 。
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
焦亚硫酸钠(Na2S2O5)常用作食品漂白剂。其制备工艺流程如下: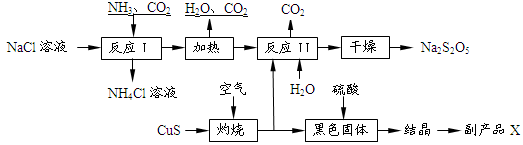
已知:反应Ⅱ包含2NaHSO3 Na2S2O5+H2O等多步反应。
Na2S2O5+H2O等多步反应。
(1)反应I的化学方程式为: 。
(2)“灼烧”时发生反应的化学方程式: 。
(3)已知Na2S2O5与稀硫酸反应放出SO2,其离子方程式为: 。
(4)副产品X的化学式是 。
(5)为了减少产品Na2S2O5中杂质含量,需控制反应Ⅱ中气体与固体的物质的量之比约为 。检验产品中含有碳酸钠杂质所需试剂是 (填编号)
①酸性高锰酸钾;②品红溶液;③澄清石灰水;④饱和碳酸氢钠溶液;⑤NaOH;⑥稀硫酸
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
一定条件下,有如下反应:
2CO (g) + O2(g)=2CO2(g) ΔH1=" -" 566.0kJ·mol-1
3Fe(s) +2O2(g)=Fe3O4 (s) ΔH2=-1118.3kJ·mol-1
Fe3O4(s)+4CO(g) 3Fe(s) +4CO2 (g) ΔH3
3Fe(s) +4CO2 (g) ΔH3
(1)试计算,ΔH3 =
(2)已知1100℃时,反应Fe3O4(s)+4CO(g) 3Fe(s)+4CO2 (g) ΔH3的化学平衡常数为4.8×10-3。若在1100℃时,测得高炉中c(CO2)=0.020mol·L-1,c(CO)=0.10mol·L-1,此时该反应 (填“是”或“否”)处于平衡状态,理由是 ,此时υ正 υ逆(填“>”、“<”或“=”)。
3Fe(s)+4CO2 (g) ΔH3的化学平衡常数为4.8×10-3。若在1100℃时,测得高炉中c(CO2)=0.020mol·L-1,c(CO)=0.10mol·L-1,此时该反应 (填“是”或“否”)处于平衡状态,理由是 ,此时υ正 υ逆(填“>”、“<”或“=”)。
(3)下列试剂可以用于吸收工业尾气中的CO2的是 。
a.(NH4)2CO3溶液 b.氨水 c.NaHSO3溶液 d.CaCl2溶液
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
化学肥料在农业生产中具有重要的作用,关系着农业生产是否丰收。化学肥料在农业生产中的广泛应用,为化学肥料的大规模工业生产提供了舞台。
(1)在合成氨的设备(合成塔)中,设置热交换器的目的是______________。
(2)生产硝酸的过程中常会产生一些氮的氧化物,一般可采用下列两种方法处理。
碱液吸收法:NO+NO2+2NaOH=2NaNO2+H2O
氨还原法:8NH3+6NO2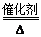 7N2+12H2O(NO也有类似的反应)
7N2+12H2O(NO也有类似的反应)
请从绿色化学的角度分析两种方法的优劣:____________________。
(3)某化肥厂用NH3制备NH4NO3。已知:由NH3制NO的产率是96%,NO制HNO3的产率是92%,则制HNO3所用去的NH3的质量占总耗用NH3质量(不考虑其他损耗)的________%。
(4)硝酸铵是一种常用的氮肥,在贮存和使用该化肥时,把应注意的事项及理由填入下表(填两条应注意的事项及理由即可)。
| | 注意事项 | 理由 |
| ① | ______________ | ____________ |
| ② | ________________ | ____________ |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com