
| A. | 9种 | B. | 13种 | C. | 10种 | D. | 11种 |
分析 分子式为C5H10O2的酯为饱和一元酯,形成酯的羧酸与醇的碳原子总数为5,讨论羧酸与醇含有的碳原子,进行书写判断.
解答 解:若为甲酸和丁醇酯化,丁醇有4种,形成的酯有四个:
HCOOCH2CH2CH2CH3、HCOOCH2CH(CH3)2、HCOOCH(CH3)CH2CH3、HCOOC(CH3)3;
若为乙酸和丙醇酯化,丙醇有2种,形成的酯有2个:CH3COOCH2CH2CH3、CH3COOCH(CH3)2;
若为丙酸和乙醇酯化,丙酸有1种,形成的酯有1个:CH3CH2COOCH2CH3;
若为丁酸和甲醇酯化,丁酸有2中,形成的酯有2个:CH3CH2CH2COOCH3、(CH3)2CHCOOCH3.
故有9种.
故选A.
点评 本题考查同分异构体的书写与判断,难度中等,关键是形成酯的羧酸与醇的同分异构体的判断.


科目:高中化学 来源: 题型:多选题
| A. | 原溶液中一定含有SCN- | B. | 原溶液中一定含有NO3- | ||
| C. | 原溶液可能呈酸性 | D. | Fe2+被Br2氧化成Fe3+ |
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
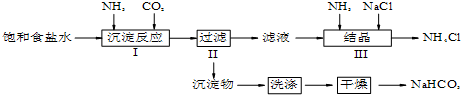
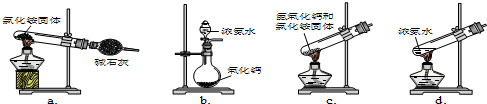
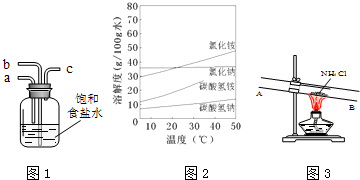
查看答案和解析>>
科目:高中化学 来源: 题型:实验题

| 平行试验次数 | 1 | 2 | 3 |
| 0.25g样品消耗硫酸铈标准溶液的体积(ml) | 24.35 | 24.05 | 23.95 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
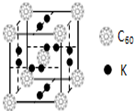 C60以其完美的球形结构受到科学家的高度重视,从此掀起了球形分子的研究热潮.继C60后,科学家又合成了Si60、N60等球形分子.
C60以其完美的球形结构受到科学家的高度重视,从此掀起了球形分子的研究热潮.继C60后,科学家又合成了Si60、N60等球形分子.查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com