
| A. | NH4+、Cl-、Na+、SO42- | B. | Na+、Ba2+、OH-、SO42- | ||
| C. | Ca2+、H+、S2-、ClO- | D. | H+、Cl-、Fe2+、NO3- |
 期末1卷素质教育评估卷系列答案
期末1卷素质教育评估卷系列答案科目:高中化学 来源: 题型:选择题
| A. | Na2O2中阴离子和阳离子 | B. | NaOH晶体中阳离子和阴离子 | ||
| C. | ${\;}_{12}^{24}$Mg2+离子中的质子和中子 | D. | 氯化钠中的质子总数和电子总数 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
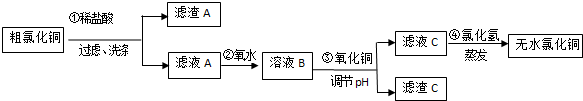
| 离子符号 | Fe3+ | Fe2+ | Cu2+ |
| 氢氧化物开始沉淀时的pH | 2.5 | 7.0 | 4.7 |
| 氢氧化物完全沉淀时的pH | 3.2 | 9.7 | 6.7 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | B. | C. | D. |
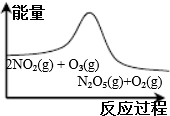 | 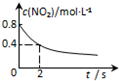 | 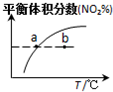 | 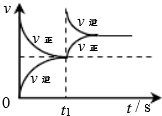 |
| 平衡后升温, NO2含量降低 | 0~2s内, v(O3)=0.2 mol•L-1•s-1 | V正:b点>a点 b点:v逆>v正 | 恒温,t1时再充入O3 |
| A. | A | B. | B | C. | C | D. | D |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 原子半径比较:X<Y<Z<W | |
| B. | X的氢化物沸点一定低于Y的氢化物 | |
| C. | Y的氢化物稳定性一定弱于W的氢化物 | |
| D. | 短周期所有元素中,Z的最高价氧化物的水化物碱性最强 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
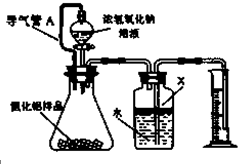 氮化铝(AIN)是一种新型的无机材料,广泛应用于集成电路生产领域.氮化铝产品中往往含有炭和氧化铝杂质.化学研究性学习小组为测定该产品中氮化铝的质量分数,取一定量的氮化铝产品,进行以下实验.已知:
氮化铝(AIN)是一种新型的无机材料,广泛应用于集成电路生产领域.氮化铝产品中往往含有炭和氧化铝杂质.化学研究性学习小组为测定该产品中氮化铝的质量分数,取一定量的氮化铝产品,进行以下实验.已知:查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 用湿润的pH试纸测溶液的pH | |
| B. | 实验室制备干燥纯净的氯气时,气体先通过饱和食盐水再通过浓硫酸 | |
| C. | 用玻璃棒在过滤器上搅拌以加速AgCl沉淀的洗涤 | |
| D. | 中和滴定实验中,锥形瓶用蒸馏水洗净后未干燥,测定结果偏低 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com