
 ijѧϰС��̽��NaHCO3��Na2HCO3�����ᣨ����Ũ�Ⱦ�Ϊ1mol��L-1����Ӧ�����е���ЧӦ��ʵ�����������ݣ�
ijѧϰС��̽��NaHCO3��Na2HCO3�����ᣨ����Ũ�Ⱦ�Ϊ1mol��L-1����Ӧ�����е���ЧӦ��ʵ�����������ݣ�| ��� | 35mL�Լ� | ���� | ����¶�ǰ/�� | ����¶Ⱥ�/�� |
| �� | ˮ | 2.5gNaHCO3 | 20.0 | 18.5 |
| �� | ˮ | 3.2gNa2CO3 | 20.0 | 24.3 |
| �� | ���� | 2.5gNaHCO3 | 20.0 | 16.2 |
| �� | ���� | 3.2gNa2CO3 | 20.0 | 25.1 |
���� ��1��̼�����������ᷴӦ�����Ȼ��ơ�������̼�����ˮ���ݴ�д����Ӧ�����ӷ���ʽ��
��2������ʵ��٢ۿ�֪��̼������������ķ�ӦΪ���ȷ�Ӧ������ʵ��ڢܿ�֪��̼����������ķ�ӦΪ���ȷ�Ӧ��
��3��̼����������ķ�ӦΪ���ȷ�Ӧ����Ӧ���������������������������ݴ˻�����Ӧǰ�������仯���ߣ�
��� �⣺��1��̼�����������ᷴӦ��ʵ��Ϊ��̼����������������ӷ�Ӧ���ɶ�����̼�����ˮ����Ӧ�����ӷ���ʽΪ��HCO3-+H+=CO2��+H2O��
�ʴ�Ϊ��HCO3-+H+=CO2��+H2O��
��2������ʵ��ٿ�֪��̼����������ˮ����Һ�¶ȴ�20�潵�͵�18.5�棬��ʵ�����̼�����������ᷴӦ����Һ�¶ȴ�20�潵��16.2�棼18.5�棬ͨ����Ӧ�����Һ�¶ȸ��ͣ�֤����Ӧ��Ϊ���ȷ�Ӧ��
ͬ��������ʵ���̼��������ˮ�����Һ�¶ȴ�20�����ߵ�24.3�棬ʵ�����̼���������ᷴӦ���¶ȴ�20�����ߵ�25.1�棾24.3�棬̼���������ᷴӦ����Һ���¶ȱ�̼��������ˮ�����ߵ��¶ȸ��ߣ�֤��̼����������ķ�ӦΪ���ȷ�Ӧ��
�ʴ�Ϊ�����ȣ����ȣ�
��3�����ݣ�2���ķ�����֪��̼����������ķ�ӦΪ���ȷ�Ӧ��˵����Ӧ�����������������������ߣ��ݴ˿ɻ����ķ�Ӧǰ�������仯����Ϊ��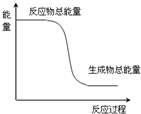 ���ʴ�Ϊ��
���ʴ�Ϊ�� ��
��
���� ���⿼����̽�����ȷ�Ӧ�����ȷ�Ӧ�ķ�������Ŀ�Ѷ��еȣ�ע�����ջ�ѧ��Ӧ�е������仯����ȷ̽�����ȷ�Ӧ�����ȷ�Ӧ�ķ���������������ѧ���ķ���������������������������



| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ�� ���ͣ�ѡ����
| A�� | �⻯��ķе㣺Zһ������Y | |
| B�� | ����������Ӧˮ��������ԣ�Xǿ��Y | |
| C�� | W��X��Y��Z���ֱܷ�����Ԫ���γɹ��ۻ����� | |
| D�� | ����W��Y��Z����Ԫ����ɵĻ����ﲻ������������ |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ������
| ���� | CH4 | CO2 | CO | H2 |
| ������� | 0.1 | 0.1 | 0.4 | 0.4 |
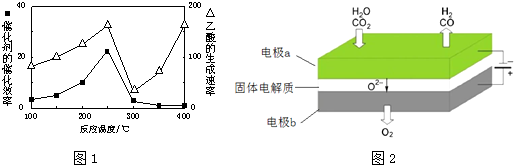
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ������
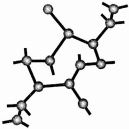 ��������һ���������ǽ������ϣ���Ҫ�Ц�-������ͦ�-���������־��ͣ����Ƕ�����[SiN4]�������干�ö���ԭ�ӹ��ɵ���ά�ռ�����ṹ����-������Ľṹ��ͼ��ʾ��
��������һ���������ǽ������ϣ���Ҫ�Ц�-������ͦ�-���������־��ͣ����Ƕ�����[SiN4]�������干�ö���ԭ�ӹ��ɵ���ά�ռ�����ṹ����-������Ľṹ��ͼ��ʾ�� ����ȥ����ԭ�Ӻ��ʣ�ಿ�ּ�Si44-��ԭ�������Ϊ����������ṹ�������ϵ�4����ԭ�ӳ�������������3������������˴���3�������������γ����ӵĻ�ѧʽΪSi3O96-��n������������˴���4���������Ӻ��γɵ����ʵĻ�ѧʽ��SiO2��
����ȥ����ԭ�Ӻ��ʣ�ಿ�ּ�Si44-��ԭ�������Ϊ����������ṹ�������ϵ�4����ԭ�ӳ�������������3������������˴���3�������������γ����ӵĻ�ѧʽΪSi3O96-��n������������˴���4���������Ӻ��γɵ����ʵĻ�ѧʽ��SiO2���鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ������

�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ������
| t/K | 298 | 398 | 498 | �� |
| K | 4.1��106 | K1 | K2 | �� |
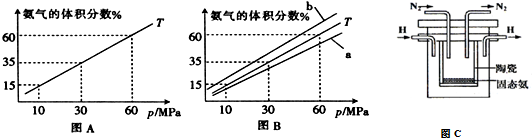
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�ѡ����
| A�� | Cl2 | B�� | HCl | C�� | HClO | D�� | H2O |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�ѡ����
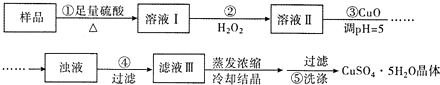
| A�� | ����ڷ�������Ҫ��ӦΪ��2Fe2++H2O2+2H+=2Fe3++2H2O | |
| B�� | ����ڿ�����ˮ�������ǿ����������H2O2 | |
| C�� | ������� CuCO3����CuOҲ�ɵ�����Һ��pH | |
| D�� | ����ݵIJ���Ϊ����©���м��������������ˮ����û���壬��ˮ��Ȼ���£��ظ����� 2��3�� |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ������
 ����MnO2���乤��ԭ����ͼ����ʾ����طŵ�ʱNa+��a����д��a����b������ͬ����������b�������õ�صĸ�����ӦʽΪBH4-+8OH--8e-=BO2-+6H2O��
����MnO2���乤��ԭ����ͼ����ʾ����طŵ�ʱNa+��a����д��a����b������ͬ����������b�������õ�صĸ�����ӦʽΪBH4-+8OH--8e-=BO2-+6H2O���鿴�𰸺ͽ���>>
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com