
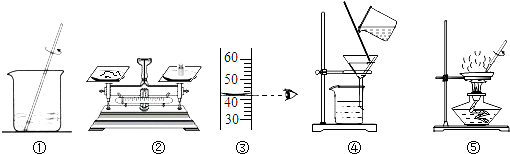
| A、甲实验的步骤是①④⑤,其中去除杂质的关键步骤是蒸发 |
| B、甲实验各步操作中,玻璃棒的作用都是相同的 |
| C、乙实验若按照②③①的步骤进行操作,砝码为5g(游码读数0),则配制的溶液浓度偏大(p水=1g/cm3) |
| D、乙实验中,若①所用的烧杯内壁沾有水,对配制的溶液浓度无影响 |


科目:高中化学 来源: 题型:
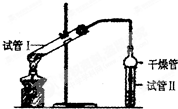 乙酸乙酯是重要的有机合成中间体,广泛应用于化学工业.实验室制备乙酸乙酯的化学方程式如下:CH3COOH+C2H5OH
乙酸乙酯是重要的有机合成中间体,广泛应用于化学工业.实验室制备乙酸乙酯的化学方程式如下:CH3COOH+C2H5OH| 浓H2SO4 |
| △ |
| 实验 编号 | 试管Ⅰ中试剂 | 试管Ⅱ中试剂 | 测得有机层的厚度/cm |
| A | 2mL乙醇、2mL乙酸、1mL 18mol/L浓硫酸 | 5.0 | |
| B | 3mL乙醇、2mL乙酸 | 0.1 | |
| C | 3mL乙醇、2mL乙酸、6mL 3mol/L硫酸 | 1.2 | |
| D | 3mL乙醇、2mL乙酸、盐酸 | 1.2 |
查看答案和解析>>
科目:高中化学 来源: 题型:
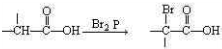
查看答案和解析>>
科目:高中化学 来源: 题型:
| X | ||
| M |
查看答案和解析>>
科目:高中化学 来源: 题型:
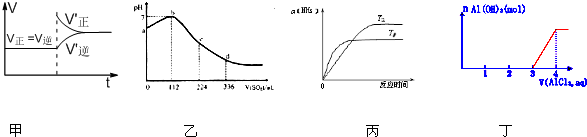
| A、甲图表示可逆反应:3Fe(s)+4H2O(g)?Fe3O4(s)+4H2 (g)增大压强后,V正、V逆变化图 |
| B、乙图是标准状况下,某同学向100mL H2S饱和溶液中通入SO2,所得溶液pH变化图.由图可知ab段反应是:SO2+2H2S═3S↓+2H2O |
| C、丙图表明合成氨反应温度与转化率之间的关系,由图知合成氨反应是吸热反应 |
| D、丁图表明向一定量的NaOH溶液中逐滴加入AlCl3溶液的反应.说明反应分两步:①Al3++3OH-=Al(OH)3↓②Al(OH)3+OH-=AlO2-+2H2O |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、混合气体一定没有甲烷 |
| B、混合气体中一定是甲烷和乙烯 |
| C、混合气体中一定没有乙烷 |
| D、混合气体中一定有乙烯 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、我国居民传统膳食以糖类为主,淀粉、脂肪都是糖类物质 |
| B、人体内的蛋白质不断分解,最终生成水和二氧化碳排出体外 |
| C、乙醇可以被氧化为乙酸,二者均能发生酯化反应 |
| D、用氢氧化钠溶液可除去乙酸乙酯中混有的少量的乙酸 |
查看答案和解析>>
科目:高中化学 来源: 题型:
 Cu3N具有良好的电学和光学性能,在电子工业领域、航空航天领域、国防领域、通讯领域以及光学工业等领域中,发挥着广泛的、不可替代的巨大作用.
Cu3N具有良好的电学和光学性能,在电子工业领域、航空航天领域、国防领域、通讯领域以及光学工业等领域中,发挥着广泛的、不可替代的巨大作用.查看答案和解析>>
科目:高中化学 来源: 题型:
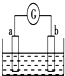 如图所示,两电极一为碳棒,一为铁片,若电流表的指针发生偏转,且a极上有大量气泡生成,则以下叙述正确的是( )
如图所示,两电极一为碳棒,一为铁片,若电流表的指针发生偏转,且a极上有大量气泡生成,则以下叙述正确的是( )| A、a为负极,是铁片,烧杯中的溶液为稀硫酸 |
| B、b为负极,是铁片,烧杯中的溶液为硫酸铜溶液 |
| C、a为正极,是碳棒,烧杯中的溶液为稀硫酸 |
| D、b为正极,是碳棒,烧杯中的溶液为硫酸铜溶液 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com