
分析 (1)依据热化学方程式书写方法解答,标注物质聚集状态和反应焓变;根据H元素守恒计算CH4的物质的量,进而计算CO的物质的量;
(2)反应中甲烷发生氧化反应,而原电池负极发生氧化反应,应在负极通入甲烷,甲烷在负极失去电子,碱性条件下生成碳酸根与水,根据反应反应方程式计算能量转化率;
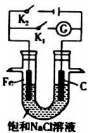
(3)①当开关K1闭合,则构成原电池,在中性环境下,金属发生的是吸氧腐蚀;
②当开关K2闭合,则构成电解池,在阳极上发生失电子的氧化反应,在阴极上发生得电子的还原反应,根据电解原理来回答.
解答 解:(1)在298K,100kPa时,CH4的燃烧热是890.0kJ/mol,在298K时,1mol CH4在氧气中完全燃烧生成二氧化碳和液态水,放出热量890.0kJ,则该反应的热化学方程式为CH4(g)+2O2(g)═CO2(g)+2H2O(l)△H=-890.0kJ/mol;18克液态水的物质的量=$\frac{18g}{18g/mol}$=1mol,根据H原子守恒可知n(CH4)=$\frac{1mol×2}{4}$=0.5mol,故n(CO)=0.75mol-0.5mol=0.25mol,则CH4和CO的物质的量的比为2:1,
故答案为:CH4(g)+2O2(g)=CO2(g)+2H2O(l)△H=-890.0kJ/mol;2:1;
(2)燃料电池中通入燃料的一极为负极,发生氧化反应,通入氧气的一极为正极,发生还原反应,故甲烷在负极失去电子,碱性条件下生成碳酸根与水,电极方程式为CH4-8e-+10OH-=CO32-+7H2O,当有12mol电子转移时,消耗甲烷$\frac{12}{8}$mol,理论上产生热量$\frac{12}{8}$mol×890.0kJ/mol,故能量转化率=$\frac{890.0}{\frac{12}{8}×890.0}×100%$≈66.7%,
故答案为:CH4-8e-+10OH-=CO32-+7H2O;66.7%;
(3)①当开关K1闭合,则构成原电池,在中性环境下,金属发生的是吸氧腐蚀,故答案为:吸氧;
②当开关K2闭合,则构成电解池,铁是阴极,在阳极上氯离子发生失电子的氧化反应,在阴极上氢离子发生得电子的还原反应,总反应式:2C1-+2H2O$\frac{\underline{\;通电\;}}{\;}$2OH-+H2↑+C12↑,
故答案为:2C1-+2H2O$\frac{\underline{\;通电\;}}{\;}$2OH-+H2↑+C12↑.
点评 本题考查热化学方程式书写、原电池与电解池的工作原理,明确电极反应及利用电子守恒、元素守恒等计算是解答本题的关键,难度中等.


科目:高中化学 来源: 题型:选择题
| A. | 维生素C中氢的质量分数约为4.5% | |
| B. | 0.352g该试样中氧元素的质量为0.192g | |
| C. | 利用该实验所得数据计算可得维生素C的分子式为C3H4O3 | |
| D. | 维生素C是一种抗氧化剂,俗称抗坏血酸,它在中性或碱性溶液中易被氧化 |
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
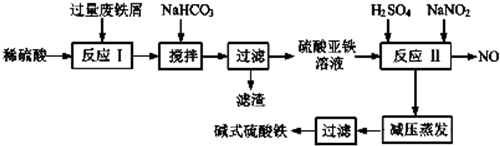
| 沉淀物 | Fe(OH)3 | Fe(OH)2 | Al(OH)3 |
| 开始沉淀 | 2.3 | 7.5 | 3.4 |
| 完全沉淀 | 3.2 | 9.0 | 4.4 |
| A.酸性KMnO4溶液 B.KSCN溶液 | C.氯水 D.NaOH溶液. |
查看答案和解析>>
科目:高中化学 来源: 题型:推断题

 ,其阴、阳离子的个数之比为1:2.
,其阴、阳离子的个数之比为1:2.查看答案和解析>>
科目:高中化学 来源: 题型:实验题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
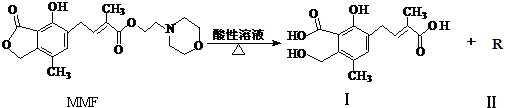
| A. | MMF分子中含有三种官能团 | |
| B. | 可以用NaHCO3溶液区别MMF与化合物Ⅰ | |
| C. | 化合物Ⅱ分子中只含碳、氢元素,属于烃类 | |
| D. | 1 mol MMF与足量NaOH 溶液共热,最多可消耗4 mol NaOH |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
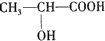 .
.查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com