
����Ŀ����ѧ��ѧ�м��ֳ������ʵ�ת����ϵ��ͼ��ʾ(ͼ�в��ַ�Ӧ��������P��Ӧ����δ�г�)��
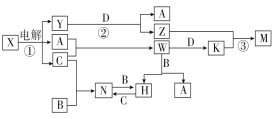
��֪��A��B��C��D�ǵ��ʣ������ǻ��������B��D�dz��������������B��Ԫ�����ڹ���Ԫ�ء���֪A��C�е�ȼ�в�ɫ���棬M�ȿ����������ֿ�����NaOH��Һ����ش��������⣺
��1��W�ĵ���ʽ�� ��
��2��д��N�Ļ�ѧʽ ������дһ��N����Ҫ��; ��
��3��д�����з�Ӧ�����ӷ���ʽ��
��Ӧ�� ��
��Ӧ�� ��
K��Һ������ˮ��Ӧ ��
���𰸡���1�� ![]()
��2��FeCl3 ��������������ˮ����ӡˢ��·ͭ�帯ʴ��������ֹѪ����(��дһ��)
��3��2Cl����2H2O![]() 2OH����H2����Cl2�� Al3����3AlO2����6H2O=4Al(OH)3��
2OH����H2����Cl2�� Al3����3AlO2����6H2O=4Al(OH)3��
Al3����3NH3��H2O=Al(OH)3����3NH4��
��������
�����������֪��A��B��C��D�ǵ��ʣ������ǻ��������B��D�dz��������������B��Ԫ�����ڹ���Ԫ�أ����B��������֪A��C�е�ȼ�в�ɫ���棬����A��H��C��Cl��M�ȿ����������ֿ�����NaOH��Һ��˵��M������������������������ת��ͼ��֪D������Y����Al��Ӧ�������������Y��ǿ���������ƣ���X��NaCl��Z��ƫ�����ƣ�W���Ȼ��⣬K���Ȼ������Ȼ�����ƫ�����Ʒ�Ӧ����������������M����������������������Ӧ�����������Ȼ��������Ȼ�������������Ӧ�����Ȼ������Ȼ���������Ӧ���Ȼ���������N���Ȼ�����
��1���Ȼ��������ۻ��������ʽ��![]() ��
��
(2N�Ļ�ѧʽ��FeCl��N����Ҫ��;Ϊ����������ˮ����ӡˢ��·ͭ�帯ʴ��������ֹѪ���ȡ�
��3���������Ϸ�����֪��Ӧ�������ӷ���ʽΪ2Cl����2H2O![]() 2OH����H2����Cl2������Ӧ�������ӷ���ʽΪAl3����3AlO2����6H2O=4Al(OH)3����K��Һ������ˮ��Ӧ�����ӷ���ʽΪAl3����3NH3��H2O=Al(OH)3����3NH4����
2OH����H2����Cl2������Ӧ�������ӷ���ʽΪAl3����3AlO2����6H2O=4Al(OH)3����K��Һ������ˮ��Ӧ�����ӷ���ʽΪAl3����3NH3��H2O=Al(OH)3����3NH4����


 �Ķ��쳵ϵ�д�
�Ķ��쳵ϵ�д�
| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ�����з�ɢϵ�з�ɢ��������С����
A. ��������Һ B. Fe��OH��3���� C. ����ֲ���ͺ�ˮ��� D. ��ˮ
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ������ʽΪC5H12O���л�������Ʒ�Ӧ�ų�H2���м���
A��4 B��6 C��7 D��8
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ���Ҵ���һ����Ҫ���л�����ԭ�ϣ������������ס������Ϊԭ�Ͼ����͡������Ƴɡ��Ҵ������;��ӹ������γɵij���ȼ�ϼ��Ҵ����͡�����й�֪ʶ���ش��������⣺
��1��д���Ҵ�������Ʒ�Ӧ�Ļ�ѧ����ʽ ______________________________
��2�����Թ������2mL�Ҵ�����һ���������״��ͭ˿���ھƾ������м��ȣ�ʹͭ˿��������һ�����ɫ������ͭ��������������ʢ���Ҵ����Թ������ͼ����ȡ��ͭ˿�����Թ۲쵽ͭ˿���� __________, ����ʵ��ʵ�����Ҵ���������Ӧ����ѧ����ʽΪ:______________________________ ����÷�Ӧ��������Լ���:_____________________________

��3�����е�˵���У���ȷ����
A���Ҵ�������һ�ִ�������ڿ�������Դ
B ʹ���Ҵ����������Խ�ʡʯ����Դ������β�����ŷ�����������
C���Ҵ������ᷴӦ���ɵ�����������һ����ɫ�����ܶȱ�ˮС����״Һ��
D������CH3CH218OH��CH3COOH����������Ӧ������������������18O
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����2016����ɽ��ģ������������һ�ֹ�ҵ�Σ������ʳ�ηdz����ƣ����Խ�ǿ��ij��ѧ��ȤС���ʳ�����������ƽ��ж�Ƕ�̽����
��һ������NaCl��NaNO2
��ͬѧ�ó���������
���飺������Ksp(AgNO2)=2��10-8�� Ksp(AgCl)=1.8��10-10���ֱ���ʢ��5mL 0.0001 mol/L��������Һ���Ժ���ͬʱ��εμ�0.0001mol/L��������Һ�������ɳ�������װ�� ��Һ���Թܡ�
��ͬѧ�ඨ��ҺpH
��pH��ֽ�ֱ�ⶨ0.1 mol/L��������Һ��pH�����NaNO2��Һ�ʼ��ԡ�����Һ�ʼ��Ե�ԭ���� �������ӷ���ʽ���ͣ���
��������С��������װ�ã���ȥ�г��������Ʊ���������

��֪���� 2NO+ Na2O2 = 2NaNO2 ��
�� ���������£�NO��NO2������MnO4һ��Ӧ����NO3һ��Mn2+��
��1��ʹ��ͭ˿���ŵ��� ��
��2��װ��A�з�Ӧ����ʽΪ ��
װ��C ��ʢ�ŵ�ҩƷ�� ��������ĸ���ţ�
A��Ũ���� B��NaOH ��Һ C��ˮ D�����Ȼ�̼
����F������ ��
��3����С���ȡ5.000g��ȡ����Ʒ����ˮ���250.0 mL��Һ��ȡ25.00mL��Һ����ƿ�У���0.1000mol/L����KMnO4��Һ���еζ���ʵ�������������±���ʾ��
����� | 1 | 2 | 3 | 4 |
����KMnO4��Һ���/mL | 20.70 | 20.12 | 20.00 | 19.88 |
�� ��һ��ʵ�����ݳ����쳣����������쳣��ԭ������� ������ĸ���ţ���
A����ƿϴ����δ����
B����ʽ�ζ���������ˮϴ����δ�ñ�Һ��ϴ
C���ζ��յ�ʱ���Ӷ���
������KMnO4��Һ�ζ�����������Һ�����ӷ���ʽΪ ��
������Ʒ���������Ƶ���������Ϊ ��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ���������ױ������ϵ���������ͬ���칹����ĿΪ�� ��
A. 1 B. 2 C. 3 D. 4
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��ij�����ڵ�Ӿʱ�����Ľ����������ƶ��������ֽ����зֱ�����������ʣ�
��������Һ������þ��Һ�����ὺ���������������壬���ᷢ���۳�����
A���٢�B���٢�C���ڢ�D���ۢ�
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����֪A��B��C��D���ֶ�����Ԫ�صĺ˵������������Aԭ��s�����������p�����������������Cԭ�ӵ�L�ܲ��������ԳɶԵ��ӣ�C��Dͬ���塣 E��F�ǵ�������Ԫ�أ���Eλ�����ڱ���ds���� Fԭ��������33�ֲ�ͬ�˶�״̬�ĵ��ӡ�����������Ϣ����Ӧ��Ԫ�ط�����գ�
��1��E+��������Ų�ʽΪ ��FC43�������Ŀռ乹��Ϊ �����以Ϊ�ȵ������һ���л�����Ϊ ���ѧʽ����
��2��BԪ���������ڵ�һ����������Ԫ���� ����Ԫ�ط�������
��3��D��������Ԫ������������Ӧ��ˮ�����У�������ǿ���� ���ѧʽ�����ܵ����A������B��D��E�ĵ����γɵľ�����Ƚϣ��۵��ɸߵ��͵�����˳���� ���ѧʽ����
��4����֪EDC4��Һ�е��백����������H2N��CH2��COONa�����ɵõ������A����ṹ��ͼ��ʾ��
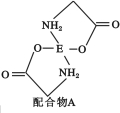
�� �����A��̼ԭ�ӵĹ���ӻ�����Ϊ ��
�� 1 mol������������H2N��CH2��COONa��������������ĿΪ ��
��5��������F2C3�����ڱ궨δ֪Ũ�ȵ�����KMnO4��Һ����Ӧ����F����ۺ����ᣬ�÷�Ӧ�����ӷ���ʽ�� ��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ���ḻ��CO2��ȫ������Ϊ��̼Դ�������ǰӦ����㷺��̼Դ��ʯ�ͺ���Ȼ��������������Ҷ���ݽߵ�Σ����
��1��Ŀǰ��ҵ����һ�ַ�������CO2��H2��230������������ת�����ɼ״���CH3OH��������ˮ����CO2��g��+3H2��g��![]() CH3OH��g��+H2O��g������ͼ��ʾ��ѹ�����г���1mol CO2��3 mol H2��ת���ʴ�50%ʱ�������仯ʾ��ͼ��д���÷�Ӧ���Ȼ�ѧ����ʽ�� ��
CH3OH��g��+H2O��g������ͼ��ʾ��ѹ�����г���1mol CO2��3 mol H2��ת���ʴ�50%ʱ�������仯ʾ��ͼ��д���÷�Ӧ���Ȼ�ѧ����ʽ�� ��

��2�����ҵ�ϻ�����CO��H2�Ʊ��״��� ��ӦΪCO��g��+2H2��g��![]() CH3OH��g����
CH3OH��g����
ij�¶��£����ݻ�Ϊ2L�ĺ����ܱ������н��и÷�Ӧ����������ݼ���ͼ��

�� t min��2t minʱ���ʱ仯��ԭ������� ��
�� 3t minʱ�Է�Ӧ��ϵ��ȡ��һ����ʩ����4t minʱCO�����ʵ���Ϊ0.5mol���������ͼCO�����ߡ�
��3��CO2��һ�������£���������H2�ϳɶ����ѣ�
2CO2��g��+6H2��g��![]() CH3OCH3��g��+3H2O��g����
CH3OCH3��g��+3H2O��g����
��2.5 mol H2��b mol CO2�����ݻ�Ϊ1 L���ܱ������У�����������Ӧ���ﵽƽ��״̬ʱ�����ʵ���������±���

�� ����ʱ������ƽ����_________�����ƶ��������Ӧ�����淴Ӧ������
�ڱ���x��y�Ĵ�С��ϵΪ_________��
A��x��y B��x��y C��x��y D�����ж�
�۱���x��y��z��w��Ӧ��ƽ�ⳣ���ֱ�ΪKx��Ky��Kz��Kw������֮��Ĵ�С��ϵΪ___________________��
�鿴�𰸺ͽ���>>
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com