
| A. | 古人利用明矾溶液的酸性来清洗青铜器上的铜锈 | |
| B. | 人体摄入适量的油脂有利于促进维生素的吸收 | |
| C. | 《肘后备急方》中记载“青蒿一握,以水二升渍,绞取汁”,所述过程不涉及化学变化 | |
| D. | 手机外壳上贴的碳纤维外膜是一种新型的有机高分子材料 |
分析 A.明矾为强酸弱碱盐,水解显酸性;
B.脂溶性维生素易溶于油脂;
C.化学变化有新物质生成,物理变化没有新物质生成;
D.碳纤维是一种新型的无机非金属材料;
解答 解:A.明矾为强酸弱碱盐,水解显酸性,能与碱式碳酸铜,可以用来清洗青铜器上的铜锈,故A正确;
B.油脂的摄入有利于脂溶性维生素的吸收,故B正确;
C.《肘后备急方》中记载“青蒿一握,以水二升渍,绞取汁”,为物质形状变化,没有新物质生成属于物理变化,故C正确;
D.碳纤维是一种新型的无机非金属材料,不是高分子材料,故D错误;
故选:D.
点评 本题考查了化学与社会生活,熟悉相关物质的性质是解题关键,注意物理变化与化学变化的区别,题目难度不大.


 名校课堂系列答案
名校课堂系列答案科目:高中化学 来源: 题型:解答题

查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 等物质的量的硫蒸气和固体硫分别完全燃烧,后者放出热量多 | |
| B. | 由C(石墨)=C(金刚石)△H=+1.90 kJ/mol可知,金刚石比石墨稳定 | |
| C. | 在101 kPa时,2 g氢气完全燃烧生成液态水,放出285.8 kJ热量,氢气燃烧的热化学方程式表示为:2H2(g)+O2(g)═2H2O(l)△H=-285.8 kJ/mol | |
| D. | 在稀溶液中,H+(aq)+OH-(aq)═H2O(l)△H=-57.3 kJ/mol,若将含0.5 mol H2SO4的浓硫酸与含1 mol NaOH的溶液混合,放出的热大于57.3 kJ |
查看答案和解析>>
科目:高中化学 来源: 题型:多选题
| A. | 该溶液中HA有0.1%发生了电离 | |
| B. | 此酸电离平衡常数约为10-7 | |
| C. | 升高温度后溶液的PH增大 | |
| D. | 若将PH=2的HA溶液与PH=12的NaOH溶液等体积混合后PH=7 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
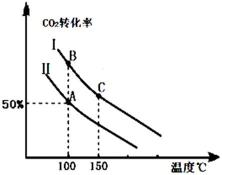 1905年德国化学家哈伯发明了合成氨的方法,他因此获得了1918年度诺贝尔化学奖.氨的合成不仅解决了地球上因粮食不足而导致的饥饿与死亡问题,在国防、能源、轻工业方面也有广泛用途.
1905年德国化学家哈伯发明了合成氨的方法,他因此获得了1918年度诺贝尔化学奖.氨的合成不仅解决了地球上因粮食不足而导致的饥饿与死亡问题,在国防、能源、轻工业方面也有广泛用途.查看答案和解析>>
科目:高中化学 来源: 题型:解答题
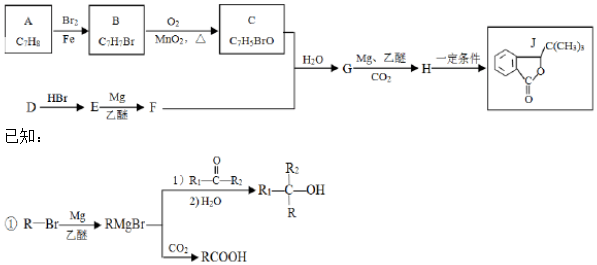
 .
. (写结构简式).
(写结构简式).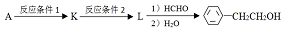
 .
.查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | ①② | B. | ②③ | C. | ①③ | D. | ③④ |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
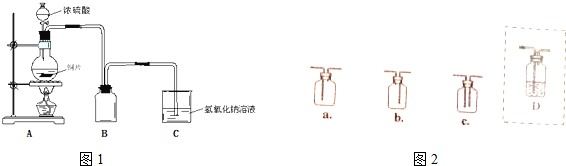
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com