
| A. | 标准状况下,5.6L二氧化碳气体中含有的氧原子数为0.5NA | |
| B. | 0.1L0.5mol/LCH3COOH溶液中含有的氢离子数为0.05NA | |
| C. | 1molFe溶于过量硝酸,电子转移数为2NA | |
| D. | 标准状况下,2.24LCC14含有的共价键数为0.4NA |
分析 A.依据n=$\frac{V}{Vm}$,结合二氧化碳分子含有2个氧原子结构特点解答;
B.醋酸为弱酸,部分电离;
C.铁与足量硝酸反应生成硝酸铁;
D.气体摩尔体积使用对象为气体.
解答 解:A.标准状况下,5.6L二氧化碳气体中含有的氧原子数为$\frac{5.6L}{22.4L/mol}$×2×NA=0.5NA,故A正确;
B.醋酸为弱酸,部分电离,0.1L0.5mol/LCH3COOH溶液中含有的氢离子数小于0.05NA,故B错误;
C.1molFe溶于过量硝酸生成1mol硝酸铁,电子转移数为3NA,故C错误;
D.标况下四氯化碳为液体,不能使用气体摩尔体积,故D错误;
故选:A.
点评 本题考查了阿伏伽德罗常数的使用及计算,熟练掌握公式的使用和物质的结构是解题关键,注意标况下四氯化碳为液体,题目难度不大.


科目:高中化学 来源: 题型:选择题
| A. | SiO2$\stackrel{HCl(ap)}{→}$SiCl4$\stackrel{H_{2}}{→}$Si | |
| B. | FeS2$→_{灼烧}^{O_{2}}$SO3$\stackrel{H_{2}O}{→}$H2SO4 | |
| C. | N2$→_{高温、高压、催化剂}^{H_{2}}$NH3$\stackrel{HCl(aq)}{→}$NH4Cl(aq) | |
| D. | MgCO3$\stackrel{HCl(aq)}{→}$MgCl2(aq)$\stackrel{电解}{→}$Mg |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题

| 物质 | 开始沉淀 | 沉淀完全 |
| Fe(OH)3 | 2.7 | 3.7 |
| Mn(OH)2 | 7.1 | 10.1 |
| Cu(OH)2 | 4.7 | 6.7 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| 实验 序号 | 试剂体积 V/mL | 显色时间 t/s | ||||
| K2S2O8溶液 | KI溶液 | 水 | Na2S2O3溶液 | 淀粉溶液 | ||
| ① | 10 | 10 | 0 | 4 | 1 | 26.8 |
| ② | 5 | 10 | 5 | 4 | 1 | 54.0 |
| ③ | 2.5 | 10 | V1 | 4 | 1 | 108.2 |
| ④ | 10 | 5 | 5 | 4 | 1 | 53.8 |
| ⑤ | 5 | 7.5 | 7.5 | 4 | V2 | t1 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
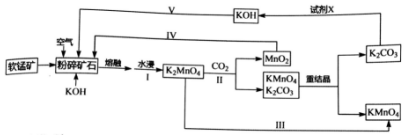
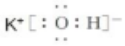 .
.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 能与NaOH溶液反应的同分异构体共有6种 | |
| B. | 存在分子中含有六元环的同分异构体 | |
| C. | 既含有羟基又含有醛基的有5种 | |
| D. | 不存在含有2个羟基的同分异构体 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题

查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 一定物质的量浓度的溶液配制过程中,仰视定容,所得溶液的浓度偏大 | |
| B. | 相同体积和相同物质的量浓度的不同溶液里所含溶质的物质的量相同 | |
| C. | 溶液中溶质质量分数为w,密度为ρ g/cm3,溶质摩尔质量为M g/mol的溶液的物质的量浓度为$\frac{pw}{M}$mol/L | |
| D. | 10 mol/L的浓盐酸与H2O等质量混合所得混合液的浓度为5 mol/L |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com