
分析 W、X、Y、Z是原子序数依次增大的四种短周期元素(稀有气体除外),其中只有Y为金属元素,X 原子L 层电子数是K 层电子数的2倍,X为碳,只有 Y 为金属元素,Y 原子最外层电子数与 W 相同,X、Z 两元素的原子序数之和为 Y 原子质子数的两倍,则W为氢,Y为钠,Z为硫,X 的单质碳与 Z 的最高价氧化物对应水化物浓溶液浓硫酸反应生生二氧化硫、二氧化碳和水,据此解答.
解答 解:W、X、Y、Z是原子序数依次增大的四种短周期元素(稀有气体除外),其中只有Y为金属元素,X 原子L 层电子数是K 层电子数的2倍,X为碳,只有 Y 为金属元素,Y 原子最外层电子数与 W 相同,X、Z 两元素的原子序数之和为 Y 原子质子数的两倍,则W为氢,Y为钠,Z为硫,
(1)根据上述分析可知W为氢(H)、X为碳(C)、Y为钠(Na)、Z为硫(S),
故答案为:氢(H);碳(C);钠(Na);硫(S);
(2)X 单质碳与 Z 的最高价氧化物对应水化物浓溶液浓硫酸反应生生二氧化硫、二氧化碳和水,方程式为C+2H2SO4(浓)$\frac{\underline{\;\;△\;\;}}{\;}$ 2SO2↑+CO2↑+2H2O,
故答案为:C+2H2SO4(浓)$\frac{\underline{\;\;△\;\;}}{\;}$ 2SO2↑+CO2↑+2H2O.
点评 本题考查结构性质位置关系应用,推断元素是解题关键,考查了学生对元素周期表的熟悉程度,注意方程式书写的条件,难度中等.


 星级口算天天练系列答案
星级口算天天练系列答案科目:高中化学 来源: 题型:推断题
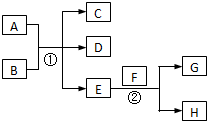 已知常温下E为无色无味的液体,F为淡黄色粉末,G为常见的无色气体(反应条件均已略去),请回答下列问题:
已知常温下E为无色无味的液体,F为淡黄色粉末,G为常见的无色气体(反应条件均已略去),请回答下列问题: .
.查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 280 | B. | 202 | C. | 124 | D. | 78 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 常温常压下,臭氧和氧气都是无色气体 | |
| B. | 臭氧与氧气可以相互转化,其反应属于氧化还原反应 | |
| C. | 臭氧具有极强的氧化性,可以将 Ag、Hg 等不活泼金属氧化 | |
| D. | 臭氧是一种很好的消毒剂,空气中存在大量的臭氧有利于人体健康 |
查看答案和解析>>
科目:高中化学 来源: 题型:计算题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 ,该化合物中含有极性共价键(填“极性”或“非极性”).
,该化合物中含有极性共价键(填“极性”或“非极性”).查看答案和解析>>
科目:高中化学 来源: 题型:解答题
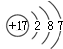 .
.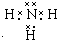 .
.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | ①⑥⑦ | B. | ③⑤⑧ | C. | ③⑦⑧ | D. | ⑤⑥⑧ |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com