
【题目】有A、B、C、D四种强电解质,它们在水中电离时可产生下列离子(每种物质只含一种阴离子且互不重复)。
阳离子 | Na+、Ba2+、NH4+ |
阴离子 | CO32-、Cl-、OH-、SO42- |
已知:
①常温下A、C溶液pH均大于7,B溶液pH小于7,D溶液pH等于7;
②C溶液和D溶液混合只产生白色沉淀;
③B溶液和C溶液混合共热时只产生刺激性气味的气体;
④A溶液和D溶液混合时无明显现象。
请回答:
(1)D的化学式_______________________。
(2)实验③反应的离子方程式_______________________。
(3)从B、C、D中选取物质,设计实验方案确定A的组成_______________________。
【答案】 Na2SO4 NH4++OH-![]() NH3↑+H2O 将A溶液与Ba(OH)2溶液混合共热,若既产生刺激性气味气体,又产生白色沉淀,则A为(NH4)2CO3;若只产生白色沉淀,则A为Na2CO3
NH3↑+H2O 将A溶液与Ba(OH)2溶液混合共热,若既产生刺激性气味气体,又产生白色沉淀,则A为(NH4)2CO3;若只产生白色沉淀,则A为Na2CO3
【解析】①A、C溶液的pH均大于7,应为碳酸盐和碱溶液,B溶液pH小于7,为铵盐,D溶液pH等于7,为强酸强碱盐;②C溶液和D溶液相遇时只生成白色沉淀,③B溶液和C溶液相遇时只生成刺激性气味的气体,则C为碱,④A溶液和D溶液混合时无明显现象,则说明C为Ba(OH)2,D为Na2SO4,则B为NH4Cl,A为碳酸盐,可能为碳酸钠,也可能为碳酸铵。
(1)根据上述分析,D为Na2SO4,故答案为:Na2SO4;
(2)实验③B溶液和C溶液混合共热时只产生刺激性气味的气体,反应的离子方程式为NH4++OH-![]() NH3↑+H2O,故答案为:NH4++OH-
NH3↑+H2O,故答案为:NH4++OH-![]() NH3↑+H2O;
NH3↑+H2O;
(3) 碳酸钠和碳酸铵的区别在阳离子不同,铵根离子能够与碱反应生成氨气,可以选用氢氧化钡检验:将A溶液与Ba(OH)2溶液混合共热,若既产生刺激性气味气体,又产生白色沉淀,则A为(NH4)2CO3;若只产生白色沉淀,则A为Na2CO3,故答案为:将A溶液与Ba(OH)2溶液混合共热,若既产生刺激性气味气体,又产生白色沉淀,则A为(NH4)2CO3;若只产生白色沉淀,则A为Na2CO3。


科目:高中化学 来源: 题型:
【题目】下列关于Na2CO3和NaHCO3的说法中,不正确的是
A. 焰色反应均为黄色
B. 溶解度:Na2CO3>NaHCO3
C. 可以用加热的方法除去Na2CO3固体中的NaHCO3杂质
D. 物质的量相同的两种固体分别与足量盐酸反应,Na2CO3产生的二氧化碳多
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】氢氧燃料电池可以使用在航天飞机上,其反应原理如图所示。下列有关氢氧燃料电池的说法中不正确的是
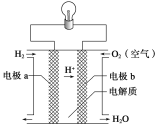
A. 该电池中电极a是正极
B. 外电路中电子由电极b通过导线流向电极a
C. 该电池的正极反应为O2+4H++4e- = 2H2O
D. 该电池的总反应:2H2+O2 = 2H2O
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】X、Y、Z、R为前四周期原子序数依次增大的元素。X原子有3个能级,且每个能级上的电子数相等;Z原子的不成对电子数在同周期中最多,且Z的气态氢化物在同主族元素的氢化物中沸点最低;X、Y、R三元素在周期表中同族。
(1)R元素基态原子的价层电子排布式为_____________________________。
(2)下图表示X、Y、Z的四级电离能变化趋势,其中表示Y的曲线是_________(填标号)。
[Failed to download image : http://192.168.0.10:8086/QBM/2018/6/1/1957930255540224/1961602752167936/STEM/676db9e64b15468faa67ccb9aa300976.png]
(3)化合物(XH2=X=O)分子中X原子杂化轨道类型分别是_____________,1mol (X2H5O)3Z=O分子中含有的σ键与π键的数目比为_______________。
(4)Z与氯气反应可生成一种各原子均满足8电子稳定结构的化合物,其分子的空间构型为________________。
(5)某R的氧化物立方晶胞结构如图所示,该物质的化学式为____________。(用元素符号表示),已知该晶体密度为ρg/cm3,距离最近的原子间距离为dpm,则R的相对原子质量为____________。(阿伏加德罗常数为NA)
[Failed to download image : http://192.168.0.10:8086/QBM/2018/6/1/1957930255540224/1961602752167936/STEM/02395761f35f4972ad3c8807ad342892.png]
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某同学将反应2Fe3++2I-=2Fe2++I2设计成下图所示的原电池:

实验步骤及现象如下:
①闭合开关,指针发生偏转,随后电流计读数逐渐变小,当读数变为零时,打开开关;
②取少许甲烧杯中溶液,滴入3~4滴淀粉溶液,溶液显蓝色;
③取少许乙烧杯中溶液,滴入3~4滴KSCN溶液,溶液显血红色;
④向乙烧杯中加入少量FeCl2固体,再次闭合开关,指针向左偏转(最后读数变为零)。
【查阅资料】灵敏电流计指针总是偏向电源正极;原电池中存在内阻,会影响反应进程。
请回答:
(1)步骤①中,开始时指针向_____(填“左"或“右”)偏转,甲烧杯中发生的电极反应式____________________。
(2)经步骤①后,乙烧杯溶液中新增金属阳离子____________(填离子符号)。
(3)步骤④中指针向左偏转,乙烧杯中发生的电极反应式______________________。
(4)要证明2Fe3++2I-![]() 2Fe2++I2 为可逆反应,你认为上述实验步骤不必做的是______________(填序号)。
2Fe2++I2 为可逆反应,你认为上述实验步骤不必做的是______________(填序号)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】(I)按要求回答下列问题:
(1)在一定的温度和压强下,2 体积 X Y 2 (g)跟 3 体积Z2(g)化合生成 2 体积气态化合物,则该气态化合物的化学式是 _________(用X、Y、Z表示)
(2)用KMnO4氧化盐酸,其反应方程式如下:2KMnO4+16HCl=2KCl+2MnCl2+5Cl2↑+8H2O,该反应中,氧化剂是________。当有1mol KMnO4和一定量盐酸恰好完全反应,反应后溶液的体积为2L ,则所得溶液中Cl—的物质的量浓度为_______,被氧化的HCl的物质的量为________。
(II)现有下列物质:①H2O、②空气、③Mg、④CaCO3、⑤H3PO4、⑥CuSO4﹒5H2O、⑦浓硝酸、⑧无水酒精、⑨硫酸、⑩盐酸。
其中,属于电解质的是____________(填序号,下同);属于非电解质的是____________;属于强电解质的是____________;能导电的是____________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知:N2(g)+3H2(g)![]() 2NH3(g)ΔH=-92.4kJ/mol起始反应物为N2和H2物质的量之比为1:3,且总物质的量不变,在不同压强和濫度下,反应达到平衡时体系中NH3的物质的量分数如下表:
2NH3(g)ΔH=-92.4kJ/mol起始反应物为N2和H2物质的量之比为1:3,且总物质的量不变,在不同压强和濫度下,反应达到平衡时体系中NH3的物质的量分数如下表:
温度 物质的量分数 压强 | 400℃ | 450℃ | 500℃ | 600℃ |
20MPa | 0.387 | 0.274 | 0.189 | 0.088 |
30MPa | 0.478 | 0.359 | 0.260 | 0.129 |
下列说法正确的是
A. 体系中NH3的物质的量分数越大,则正反应速率越大
B. 反应达到平衡时,N2和H2的转化率之比均为1
C. 反应达到平衡时,放出的热量均为92.4kJ
D. 600℃,30MPa下反应达到平衡时,生成NH3的物质的量最多
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列反应不属于氧化还原反应的是
A. Zn+2HCl===ZnCl2+H2↑
B. Ca(ClO)2+2HCl===CaCl2+2HClO
C. Pb3O4+8HCl(浓)===3PbCl2+Cl2↑+4H2O
D. 3Cl2+6KOH(浓)![]() 5KCl+KClO3+3H2O
5KCl+KClO3+3H2O
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】我国的矿产资源丰富。利用某冶炼废渣(主要成分为二氧化硅和锡、铜、铅、铁的氧化物)回收锡、铜、铅的工艺流程如下图所示:

回答下列问题:
(1)电炉冶炼时,焦炭的作用是________(填“氧化剂”或“还原剂”),将焦炭粉碎的目的是__________。熔剂的主要成分是氟石(CaF2),高温下能与SiO2反应生成两种钙盐,其中之一为 CaSiF6,该反应的化学方程式为____________________________。![]()
(2)脱铁后的溶液中含有少量的Sn2+,为减少锡的损失,可用锡、铜、铅、铁多元合金回收处理,反应的离子方程式为____________________________。
(3)已知SnO2不溶于稀硫酸。脱铁后氧化焙烧的目的是__________________。
(4)电解CuSO4溶液时,阳极的电极反应式为___________________________。
(5)已知H2CO3的一、二级电离常数分别为K1、K2,PbSO4、PbCO3的溶度积常数分别为Ksp(PbSO4)、Ksp(PbCO3)。锡、铅渣中的铅主要以PbSO4存在,脱硫时发生的反应为:
PbSO4(s)+HCO3ˉ(aq) ![]() PbCO3(s)+H+(aq)+SO42-(aq),该反应的平衡常数K=___________(用上述已知常数表示)。脱硫后需过滤、洗涤再进入下一步工序,检验滤渣是否洗涤干净的方法是_____________________________。
PbCO3(s)+H+(aq)+SO42-(aq),该反应的平衡常数K=___________(用上述已知常数表示)。脱硫后需过滤、洗涤再进入下一步工序,检验滤渣是否洗涤干净的方法是_____________________________。
(6)若该冶炼废渣中锡的质量分数为5%,30t废渣制得精锡lt,则锡的回收率为_____________________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com