

 .
.分析 (1)氨分子中氢原子被氨基(-NH2)取代后的生成物叫肼,分子中全部为单键;
(2)正极是氧气得电子发生还原反应,负极肼失电子发生氧化反应;
(3)在303K,NiPt催化下,则发生N2H4(l)?N2(g)+2H2(g),设生成氮气的量为xmol,则氢气的量为:2xmol,此时N2H4(l)的物质的量为(1-x)mol,根据4min时比值为3,求出x的值,然后根v=$\frac{△c}{△t}$计算.
解答 解:(1)氨分子中氢原子被氨基(-NH2)取代后的生成物叫肼,分子中全部为单键,电子式为: ,故答案为:
,故答案为: ;
;
(2)正极是氧气得电子发生还原反应,负极肼失电子发生氧化反应,所以a电极为电池的负极,故答案为:a;
(3)在303K,NiPt催化下,则发生N2H4(l)?N2(g)+2H2(g),设生成氮气的量为xmol,则氢气的量为:2xmol,此时N2H4(l)的物质的量为(0.1-x)mol,根据4min时比值为3,所以$\frac{3x}{0.1-x}$=3,则x=0.05mol,v=$\frac{△c}{△t}$=$\frac{\frac{0.05}{1}}{4}$=0.0125mol•L-1•min-1,故答案为:0.0125mol•L-1•min-1.
点评 本题考查较为综合,涉及电子式、原电池原理、反应速率的计算及图象问题等,题目难度不大,应用好题干信息是解题的关键.


 长江作业本同步练习册系列答案
长江作业本同步练习册系列答案科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 离子的氧化性由强到弱的顺序为:Br->I->S2- | |
| B. | 离子的还原性由强到弱的顺序为:S2->I->S2- | |
| C. | 元素的非金属性由强到弱的顺序为:S>I>Br | |
| D. | 单质的氧化性由强到弱的顺序为:Br2>I2>S |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 足量的Cu与含有0.2molH2SO4的浓硫酸共热可生成SO2为0.1NA | |
| B. | 标准状况下,22.4LCCl4中含有的分子数目为NA | |
| C. | 7.8gNa2S和Na2O2的混合物中,含有的阴离子数目为0.1NA | |
| D. | 标准状况下,2.24LCl2与足量的NaOH溶液反应,转移的电子数目为 0.2NA |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题

查看答案和解析>>
科目:高中化学 来源: 题型:填空题
 ③金刚石 ④35Cl ⑤
③金刚石 ④35Cl ⑤
 ⑦
⑦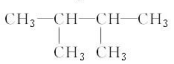 ⑧氯气 ⑨石墨 ⑩37Cl
⑧氯气 ⑨石墨 ⑩37Cl
查看答案和解析>>
科目:高中化学 来源: 题型:计算题
 向某体积固定的密闭容器中加入0.3mol A、0.1mol C和一定量(未知)的B三种气体,一定条件下发生反应,各物质浓度随时间变化如图所示.已知在反应过程中混合气体的平均相对分子质量没有变化.请回答:
向某体积固定的密闭容器中加入0.3mol A、0.1mol C和一定量(未知)的B三种气体,一定条件下发生反应,各物质浓度随时间变化如图所示.已知在反应过程中混合气体的平均相对分子质量没有变化.请回答:查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 7.8g Na2O2 与足量的 CO2充分反应转移的电子数为 0.2NA | |
| B. | 常温常压下,23gNO2和N2O4混合气体中含氧原子数为 NA | |
| C. | l04g 苯乙烯(C6H5‐CH=CH2 )中含有 8NA的碳氢键和 4NA的碳碳双键 | |
| D. | 将1mol氯气通入足量水中,则 N(HClO)+N(Cl-)+N(ClO-)=2NA |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com